- Рекоммендации АФР online
- Лимфедема конечностей. АФР 1_2023
Рекомендации АФР online
Поиск по разделу Клинические рекомендации
Клинические рекомендации
Российские клинические рекомендации по диагностике и лечению лимфедемы конечностей
Код версии (ID): 1_2023
Разработчик клинической рекомендации:
Ассоциация флебологов России
При участии:
Ассоциация лимфологов России
Российское общество хирургов
Российское общество ангиологов и сосудистых хирургов
Ассоциация сердечно-сосудистых хирургов России
Национальная ассоциация экспертов санаторно-курортного лечения
Коллектив авторов:
Илюхин Е.А., Фейсханов А.К., Ровная А.В., Апханова Т.В., Байтингер В.Ф., Белянина Е.О., Букина О.В., Дамато Андреа; Демехова М.Ю., Калинин Р.Е., Каторкин С.Е., Кончугова Т.В., Кульчицкая Д.Б., Курочкина О.С., Кушнарчук М.Ю., Летягин А.Ю., Макаров И.Г., Макарова Н.В., Мельников М.А., Мышенцев П.Н., Николаева Е.С., Нимаев В.В., Прядко С.И., Сапелкин С.В., Светликов А. В., Сильчук Е.С., Синицын А.А., Филина Ю.В., Фионик О.В., Черняго Т.Ю., Шевела А.И., Шиманко А.И., Яровенко Г.В., Стойко Ю.М., Золотухин И.А., Уртаев Б.М., Сучков И.А.
Рекомендации утверждены голосованием Исполнительного Совета АФР (голосование ИС №58 09.12.2023). Текст рекомендаций направлен на утверждение в МЗ РФ и может быть обновлен по результатам рецензирования и утверждения.
Полный текст рекомендаций с навигацией по оглавлению представлен ниже.
Также Вы можете использовать КР "Лимфедема конечностей" в pdf формате: КР Лимфедема конечностей
Список сокращений
AGREE – оценочный инструмент анализа руководств, клинических рекомендаций (Appraisal Of Guidelines For Research & Evaluation);
AMSTAR – инструмент оценки качества систематических обзоров;
CEAP – международная классификация хронических заболеваний вен нижних конечностей;
ICG – лимфография флуоресцентная (indocyanine green, ICG, ICG-лимфография). Синоним – NIR-лимфография;
ISL –Международное общество лимфологов (International Society of Lymphology);
LPG – разновидность аппаратно-роликового массажа, аббревиатура образована из трех заглавных букв в имени создателя метода;
NIR – лимфография флуоресцентная (near-infrared (NIR) lymphography, NIR-лимфография). Синоним – ICG-лимфография;
NPWT – вакуумное лечение (negative pressure wound therapy);
PRISMA – стандарты представления систематических обзоров;
RLCS – синдром рецидивирующего лимфангитического целлюлита (recurrent lymphangitic cellulitis syndrome);
SD – стандартное отклонение (standard deviation);
АЛР – Ассоциация лимфологов России;
АФР – Ассоциация флебологов России;
ДИ – доверительный интервал;
ДНК – дезоксирибонуклеиновая кислота;
ИМТ – индекс массы тела;
КМБ – компрессионный многослойный бандаж, компрессионное многослойное бандажирование;
КТ – компьютерная томография;
КФПТ - комплексная физическая противоотечная терапия (Complete Decongestive Therapy (CDT), Complete Decongestive Physiotherapy (CDP));
ЛВА – лимфовенозный анастомоз;
ЛНВА – лимфонодуловенозный анастомоз;
ЛПИ – лодыжечно-плечевой индекс;
ЛФК – лечебная физкультура;
МЛД – мануальный лимфодренаж (manual lymphatic drainage, MLD);
МР-лимфография – магнитно-резонансная лимфография (бесконтрастная);
МРТ – магнитно-резонансная томография;
НИЛТ – низкоинтенсивная лазерная терапия (low-level laser therapy, LLLT), известна также как фотобиомодуляционная терапия (ФБМТ, photobiomodulation therapy, PBMT);
НПВ – нижняя полая вена;
ОР – относительный риск;
ОШ – отношение шансов;
ПЖК – подкожная жировая клетчатка;
ППК - перемежающаяся пневматическая компрессия (аппаратная пневмокомпрессия, intermittent pneumatic compression);
ПТБ – посттромботическая болезнь;
РКИ – рандомизированное контролируемое исследование;
РКС – регулируемая компрессионная система (adjustable compression wrap devices);
РМЖ – рак молочной железы;
СКФ – скорость клубочковой фильтрации;
СЛД – самостоятельный лимфодренаж, («простой» мануальный лимфодренаж, simple lymphatic drainage (SLD), self-massage);
СРС – стандартизованная разность средних;
СТС – синдром Стюарта–Тривса (Steward Treves syndrome);
ТБС – тазобедренный сустав;
ТВЛ – трансплантация васкуляризованных лимфоузлов;
УДД – уровень достоверности доказательств;
УЗДС – ультразвуковое дуплексное сканирование;
УУР – уровень убедительности рекомендации;
ХВН – хроническая венозная недостаточность;
ХОЗАНК – хроническое облитерирующее заболевание артерий нижних конечностей;
ХСН – хроническая сердечная недостаточность.
Термины и определения
Отек с ямкой, отек без ямки – аналоги англоязычного обозначения «мягкого» отека с появлением ямки при продолжительном надавливании (pitting edema) и плотного отека, когда ямка при надавливании не образуется (non-pitting edema).
Лимфедема, связанная с диагностикой и лечением рака – лимфедема, развившаяся вследствие повреждения лимфатических путей при проведении диагностических и/или мероприятий по поводу злокачественного новообразования. Допустимо применение термина «рак-ассоциированная лимфедема», его частного варианта - «РМЖ-ассоциированная лимфедема» (по аналогии с англоязычным термином «breast cancer-related lymphedema»), постмастэктомический отек.
Злокачественная лимфедема - лимфедема, развившаяся вследствие поражения путей оттока лимфы (лимфатические узлы, лимфатические сосуды) в результате сдавления или распространения по ним опухолевого процесса.
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Лимфедема - врожденное или приобретенное хроническое прогрессирующее заболевание, характеризующееся нарушением транспортной функции лимфатического русла, основным проявлением которого является увеличение в объеме пораженной части тела за счет высокобелкового отека, а в последующем, развития фиброза мягких тканей и избыточного роста жировой ткани.
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
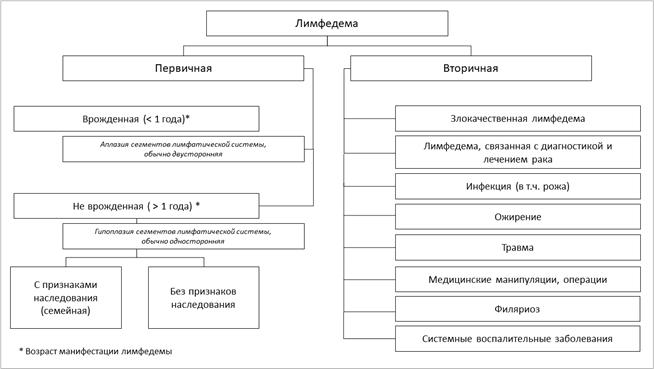
По этиологии лимфедема конечностей может быть первичной или вторичной. Вторичная лимфедема встречается значительно чаще первичной [1]. Этиология лимфедемы схематично представлена на Рисунке 1 [2]:
Рисунок 1. Этиология лимфедемы (по материалам по Kerchner K. с соавт.)
1.2.1. Патогенез лимфедемы
Длительно существующее повышенное эндолимфатическое давление является ключевым моментом в патогенезе лимфедемы. Нарушаются механизмы регуляции сократительной активности лимфангионов – функционально-структурной единицы лимфатических сосудов, снижается их насосная и емкостная функции. Постепенно разрушается структура сократительного аппарата лимфатических коллекторов: уменьшается количество миоцитов с постепенным полным разрушением мышечного слоя, с деструктивными изменениями лимфангионов. Насосная функция их полностью утрачивается, просвет лимфатических сосудов облитерируется. В результате происходит нарушение дренажа интерстициальной жидкости в лимфатическое русло и переполнение межуточного вещества жидкостью с высоким содержанием белка, фрагментов клеток и продуктов их жизнедеятельности. Накопление этого содержимого в коже, в подкожной клетчатке вызывает развитие сложных патогистологических реакций с нарушением межклеточного взаимодействия, выбросом клетками провоспалительных цитокинов, что вызывает хроническое воспаление, влечет за собой ремоделирование межклеточного вещества, увеличение объема соединительнотканного матрикса. Это приводит к дистрофическим изменениям тканей с разрастанием соединительной ткани и развитием фиброза; к увеличению объема частей тела в зоне поражения, и впоследствии, к вторичному нарушению лимфатического транспорта и дренажа [3–10].
1.2.2. Первичная лимфедема.
Первичная лимфедема — редкое заболевание, которое обусловлено генетическим дефектом и развивается без провоцирующего фактора. Лимфатический отек возникает в результате врожденной аномалии лимфатической системы и связан с дисплазией, гипоплазией или гиперплазией компонентов лимфатической системы. Первичная лимфедема чаще всего затрагивает нижние конечности, но может возникать и в верхних конечностях [11]. Если отмечено возникновение первичной лимфедемы у членов одной семьи в одном или нескольких поколениях, может быть использован термин «семейная лимфедема». Некоторые генетические нарушения, такие как болезнь Фабри (болезнь Андерсона-Фабри), могут сопровождаться развитием лимфедемы, однако, если она не характерна для данной аномалии, лимфедема считается вторичной [12]. Первичная лимфедема может классифицироваться по локализации, причине, возрасту и семейной истории лимфатических заболеваний. В настоящее время обычно выделяют пять подгрупп первичной лимфедемы, которые отличаются возрастом проявления и клинической картиной:
- Врожденная лимфедема, которая проявляется в возрасте до 1 года, без системных нарушений, отёки являются главным клиническим признаком.
- Лимфедема, которая возникает после 1 года жизни, отёки являются главным клиническим признаком.
- Лимфедема с системными или внутренними лимфатическими нарушениями: плевральный выпот, перикардиальный выпот, асцит, хилезный рефлюкс, энтеропатия с потерей белка/кишечная лимфангиэктазия или внутриутробный отек (водянка плода).
- Синдромальная (синдромная) лимфедема: врожденные синдромы/аномалии развития, которые сопровождаются лимфатическими отёками, но лимфедема не является основным признаком заболевания (синдром Шерешевского-Тёрнера, синдром Нунан).
- Лимфедема, которая связана с лимфатическими мальформациями, сосудистыми мальформациями или сегментарным избыточным ростом (синдром Протея, Клиппеля-Треноне-Вебера) [13].
Существует много хромосомных или генетических аномалий, для которых лимфедема является характерной особенностью [14]. В 1998 г. впервые показана ассоциация мутаций FLT4 с первичной врожденной лимфедемой, в 2000 г. показано, что лимфедема-дистихиаз может быть вызвана мутациями FOXC2 [13]. В настоящее время определено около 20 генов, которые могут участвовать в развитии первичной лимфедемы, в том числе FLT4 (VEGFR3), GJC2, FOXC2, SOX18, GATA2, CCBE1, PTPN14, KIF1, VEGFC, HGF, MET, PIEZO1 и EPHB4 [11,14–17]. Эти гены определяют 25-36% случаев первичной лимфедемы, другие формы заболевания могут возникать в результате полигенных дефектов или затрагивать иные гены [13,17]. Первичная лимфедема наследуется по аутосомно-доминантному или аутосомно-рецессивному типу, но также может возникать в результате de novo мутаций в половых клетках или во время эмбриогенеза [17]. Первичная врожденная лимфедема (лимфедема Нонна-Милроя, болезнь Милроя, наследственная лимфедема I типа, наследственная лимфедема IA, лимфатическая мальформация 1, LMPHM1, OMIM 153100) вызвана мутациями гена FLT4 (Fms Related Receptor Tyrosine Kinase 4, Fms-подобная тирозинкиназа 4), который экспрессируется во всех сосудах во время эмбриогенеза и является одним из важнейших генов, ответственных за развитие лимфатической системы[17–19]. Ген FLT4 состоит из 31 экзона и кодирует рецептор фактора роста эндотелия сосудов VEGFR3 (Vascular Endothelial Growth Factor Receptor 3). На сегодняшний день выявлено более 70 патогенных мутаций в экзонах 17-20 и 22-26 FLT4, кодирующих внутриклеточный тирозинкиназный домен рецептора [16,17,20]. Лимфедема Нонна-Милроя обычно наследуется как аутосомно-доминантное заболевание с неполной пенетрантностью (80-90%), однако нередко происходят и de novo мутации [21]. Обычно заболевание проявляется с рождения, характеризуется двусторонним отёком нижних конечностей вследствие гипоплазии или аплазии лимфатических сосудов, иногда пренатально выявляется плевральный выпот или водянка плода. Клинически схожее заболевание (Милрой-подобная лимфедема, лимфатическая мальформация 4, LMPHM4, OMIM 615907) вызывают патогенные мутации в гене VEGFC, кодирующем лиганд VEGFR3 [11,13,19]. Синдромная лимфедема и лимфедема с системными или внутренними лимфатическими нарушениями (такими как хилоторакс или хилезный асцит) зачастую наблюдается у пациентов с активирующими мутациями в генах сигнального пути RAS: PTPN11, SOS1 (синдром Нунан 1), KRAS (синдром Нунан 3, сердечно-кожно-лицевой синдром), HRAS (синдром Костелло), RAF1 (синдром Нунан 5). Наиболее часто лимфедема наблюдается при синдромах лимфедема-дистихиаз (FOXC2), Хеннекама (CCBE1), Эмбергера (GATA2), микроцефалии-хориоретинопатии-лимфедемы-умственной отсталости/MCLMR (KIF11), болезни Мейджа (GJC2), которые также характеризуются врожденными пороками и нарушениями физического и умственного развития [11,13].
1.2.3. Вторичная лимфедема
Вторичная лимфедема развивается как осложнение другого заболевания или вмешательства в результате повреждения лимфатического русла с нарушением тока лимфы, стагнацией лимфы в лимфатических сосудах и повышением эндолимфатического давления [5].
Наиболее частые причины развития вторичной лимфедемы:
- Злокачественная лимфедема – отек, возникающий из-за поражения путей оттока лимфы (лимфатические узлы, лимфатические сосуды) в результате сдавления или распространения по ним опухолевого процесса;
- Лимфедема, связанная с диагностикой и лечением рака - повреждение путей оттока лимфы при диагностических и лечебных мероприятиях, связанных с лечением рака (пункция или биопсия лимфоузлов, диссекция лимфоузлов, лучевая терапия, пересечение лимфатических коллекторов и др.);
- Инфекция (в т.ч. рожа);
- Ожирение;
- Травма;
- Лимфедема, ассоциированная с медицинскими манипуляциями и операциями, не связанными с лечением рака (пункция или биопсия лимфоузлов, хирургические операции с вмешательством в зонах расположения лимфатических сосудов и коллекторов и др.);
- Системные воспалительные заболевания;
- ХВН;
- Филяриоз.
В отношении лимфедемы, ассоциированной с диагностикой и лечением рака, допустимо применение термина «рак-ассоциированная лимфедема», в отношении лимфедемы, связанной с диагностикой и лечением РМЖ – «РМЖ-ассоциированная лимфедема» (brest cancer related lymphedema). Вариант лимфедемы, связанный с хирургическим лечением рака молочной железы, может называться «постмастэктомическим отеком». Злокачественная лимфедема к данным состояниям не относится.
1.2.3.1. Злокачественная лимфедема.
Злокачественная лимфедема возникает из-за поражения путей оттока лимфы (лимфатические узлы, лимфатические сосуды) в результате сдавления или распространения по ним опухолевого процесса.
1.2.3.2. Лимфедема, связанная с диагностикой и лечением рака.
Патогенетическими механизмами развития рак-ассоциированной лимфедемы (лимфедемы, ассоциированной с лечением рака) являются [22–26]:
- Прерывание лимфатических путей при удалении опухоли;
- Прерывание лимфатических путей при удалении лимфатических узлов (диссекции лимфатических узлов);
- Облитерация лимфатических путей в зоне облучения при лучевой терапии;
- Воздействие некоторых лекарственных средств.
Лимфаденэктомия (диссекция лимфатических узлов) – одна из основных причин развития вторичной лимфедемы. Риск ее формирования зависит от объема выполненной лимфаденэктомии. В крупном проспективном когортном исследовании при сроке наблюдения 18 мес. доля пациенток с появлением лимфедемы в группе с удалением <5 лимфоузлов составила 3,3%, в группе с удалением ≥5 лимфоузлов составила 18,2% (различия достоверны) [27]. При удалении только одного сторожевого лимфатического узла вероятность развития отека верхней конечности составляет примерно до 3%. А риск возникновения лимфедемы после операции с лимфодиссекцией до 8–10 лимфоузлов достигает 30% [28,29]. По результатам анализа только проспективных исследований в систематическом обзоре DiSipio T. с соавт. частота развития РМЖ-ассоциированной лимфедемы в целом составила 21,4% (95%ДИ 14,9-29,8), при этом у женщин, перенёсших диссекцию подмышечных лимфоузлов, она составила 19,9% (95%ДИ 13,5-28,2, 18 исследований), а после биопсии сторожевого узла в 3,5 раза меньше - 5,6% (95%ДИ 6,1-7,9, 18 исследований) [30]. Понятие сторожевого лимфатического узла появилось в 70-х годах [31]. Сторожевой лимфатический узел чаще является первым узлом в лимфатическом бассейне, через который происходит дренаж из анатомического региона. Затем, в 90-е годы, было предложено лимфатическое картирование с целью выявления сторожевого лимфатического узла [32]. Дальнейшее развитие изучение регионарного лимфодренирования получило в работах Suami H. с соавт., которые предложили теорию «лимфосомов» [33]. Согласно этой теории лимфосом – это очерченная область кожи или мягких тканей, расположенных надфасциально, лимфодренаж от которой осуществляется в один лимфатический узел или группу узлов в одном и том же лимфатическом бассейне. Suami H. с соавт. представили подробную карту лимфооттока от верхней конечности в норме и при диссекции регионарных лимфатических узлов [34,35]. В развитии РМЖ-ассоциированной лимфедемы существенное значение имеют особенности дренирования лимфы из верхней конечности и наличие и распределение опухолевого поражения в регионарных лимфатических узлах.
В норме лимфодренаж от верхней конечности осуществляется по двум лимфосомам в системе поверхностных лимфатических сосудов (от передне-медиальной и задне-латеральной поверхностей верхней конечности) и по системе глубоких лимфатических сосудов. Прямые связи между поверхностной (эпифасциальной) и глубокой (субфасциальной) лимфатическими системами верхней конечности в норме отсутствуют. После лимфодиссекции подмышечных лимфатических узлов наступает обструкция либо резкое уменьшение числа лимфатических сосудов от лимфосома, дренирующего переднемедиальную поверхность верхней конечности. При этом сохраняется лимфодренаж от лимфосома, дренирующего задне-латеральную поверхность верхней конечности [36].
Лучевая терапия. Основным патогенетическим механизмом формирования или усиления вторичной лимфедемы вследствие проведения лучевой терапии является дисфункция микроциркуляторного русла. Под воздействием ионизирующего излучения в эндотелиальных клетках происходит повреждение ДНК, клеточный апоптоз. Это приводит к функциональным нарушениям микроциркуляторного русла, гипоксии облученной ткани и запускает механизм развития фиброза мягких тканей [37–39].
Химиотерапия. В ряде исследований было показано, что химиотерапия таксанами, доцетакселом, доксорубицином, циклофосфамидом приводит к увеличению риска развития лимфатического отека вскоре после завершения системного лечения. Патофизиологические механизмы этих изменений не изучены [22,40,41].
1.2.3.3. Инфекция
Причиной развития лимфедемы может быть острая или рецидивирующая кожная инфекция (рожа, другие инфекционные целлюлиты), лимфаденит, туберкулез и другие [42–45].
1.2.3.4. Ожирение
В исследовании Greene A. С соавт. среднее значение индекса массы тела (ИМТ) пациентов с ожирением и лимфедемой (ИМТ = 70,1 кг/м2, диапазон 59,7 кг/м2 - 88,1 кг/м2) было значительно выше, чем среднее значение ИМТ пациентов с ожирением, но без лимфедемы (ИМТ = 42,0 кг/м2, диапазон 30,7 кг/м2 - 53,3 кг/м2), p<0,001 [46].
Ассоциация между повышением ИМТ более 50 и повышенным риском развития лимфедемы показана в исследовании Mehrara B. [47].
1.2.3.5. Травма
Обширные повреждения мягких тканей (травмы, ожоги, если они затрагивают глубоко лежащие ткани, травма Мореля-Лавалле (дегловинг) - закрытое скальпирующее повреждение мягких тканей с травматической отслойкой кожи и подкожной клетчатки от подлежащей фасции, могут привести к разрушению лимфатических структур и развитию вторичной лимфедемы [48–51]. Хронический отек в области рубцов определенного типа после пластических операций может быть вызван локальным нарушением лимфодренажа [52].
1.2.3.6. Лимфедема, ассоциированная с медицинскими вмешательствами, не связанными с лечением рака
Вмешательства, не связанные с лечением рака (пункция или биопсия лимфоузлов, хирургические операции с пересечением лимфатических коллекторов и др.) могут привести к развитию лимфедемы. В частности, эндопротезирование коленного и тазобедренного сустава ассоциированы с повышенным риском развития лимфедемы [53].
1.2.3.7. Системные воспалительные заболевания
Описаны случаи формирования вторичной лимфедемы вследствие ревматоидного или псориатического артрита, ювенильного ревматоидного артрита, хронического дерматита/экземы [54–64]. Механизм развития такой лимфедемы неизвестен, предполагается фиброз лимфатических сосудов вследствие периартрита. Однако отмечаются случаи регресса лимфедемы при снижении активности основного заболевания [65].
1.2.3.8. Хроническая венозная недостаточность
В ряде руководств для обозначения сочетания лимфедемы и хронической венозной недостаточности (ХВН) используется термин «флеболимфедема» [66,67]. В клинических рекомендациях по лимфедеме от Международного общества флебологов предлагается выделение первичной и вторичной флеболимфедемы [68]. Под первичной флеболимфедемой понимается сочетание врожденного порока развития и венозной, и лимфатической системы одновременно, т.е. комбинацию венозной и лимфатической мальформаций. При вторичной флеболимфедеме несостоятельность лимфатической системы развивается в результате венозной недостаточности, обычно на почве посттромботической болезни. Соответственно, вторичная флеболимфедема как правило ограничена локальными/региональными изменениями. Такой подход имеет существенные недостатки:
- Отсутствует обозначение комбинации первичной не врожденной лимфедемы и хронической венозной недостаточности, развившихся независимо друг от друга;
- К флеболимфедеме может быть отнесен венозный отек при отсутствии патологии лимфатической системы.
В частности, в консенсусном международном документе по диагностике и лечению лимфедемы к флеболимфедеме приравнивается любой отек при хронической венозной недостаточности (классы хронических заболеваний вен С3 – С6 по CEAP) [66]. При этом, в обоснование такой позиции приводятся исследования, демонстрирующие изменения в лимфатических сосудах в зоне венозных трофических изменений кожи, (липодерматосклероза и язв). Такое обоснование не позволяет отнести к «флеболимфедеме» стадию ХВН C3 по CEAP (наличие отека без трофических изменений кожи).
В связи с этим, при сочетании лимфедемы и патологии вен конечности рекомендуется разделять эти диагнозы, т.е. описывать заболевание вен по международной классификации СЕАР, а лимфедему - как первичную или вторичную. Подробнее правила формулировки диагноза, применимость термина «флеболимфедема», условия его использования, рассмотрены в пункте «Примеры формулировки диагноза» раздела «Классификация».
1.2.3.9. Филяриоз (филяриатоз)
Филяриоз (филяриатоз) – группа трансмиссивных гельминтных заболеваний, вызываемых филяриями – нематодами, паразитирующими в лимфатической системе и подкожной клетчатке. Является наиболее распространенной причиной вторичной лимфедемы во всем мире за счет широкого распространения в странах с тропическим и субтропическим климатом [69]. Филяриоз распространяется от человека к человеку при укусах комаров. Для заражения требуются множественные укусы инфицированными комарами в течение длительного времени (месяцы и годы), поэтому туристы имеют очень низкий риск заражения [70]. В Российской Федерации филяриоз протекает атипично, с отсутствием в тканях половозрелых нематод и микрофилярий, поэтому болезнь не осложняется формированием лимфедемы, как в тропических и субтропических странах [71].
1.2.3.10. Другие факторы развития вторичной лимфедемы.
Среди возможных причин возникновения вторичной лимфедемы упоминаются саркоидоз, подокониоз, претибиальная микседема, длительная иммобилизация/паралич) [72]. Генетическая предрасположенность может увеличивать риск развития вторичной лимфедемы различного генеза. У части пациентов выявлены полиморфизмы некоторых генов, ответственных за лимфангиогенез (ген GJC2), которые могут участвовать в патогенезе вторичной лимфедемы, вызывая нарушение эндотелиального апоптоза. В ряде исследований указывается на выявленные приоритетные гены (KDR, TEK, MAP3K5, ABL1, PLCG1, CCL2, FASLG, DAB2IP, ICAM1 и SERPINE1) из числа генов, вовлеченных в эндотелиальный апоптоз, которые могут быть ассоциированы с лимфедемой. Однако молекулярно-генетические основы патогенеза лимфедемы в настоящее время изучены не полностью [73–77].
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
1.3.1. Первичная лимфедема.
Первичная лимфедема чаще встречается у женщин, чем у мужчин. На врожденную лимфедему по некоторым оценкам приходится от 10 до 25 процентов случаев первичной лимфедемы [2,78]. Наиболее часто манифестация первичной лимфедемы происходит в возрасте до 35 лет. В этот период соотношение развития лимфедемы у женщин и мужчин составляет 4:1. В 70% развивается лимфедема одной из нижних конечностей [79]. По некоторым данным, заболеваемость первичной лимфедемой с манифестацией до 35 лет составляет 1:6000 [80]. На манифестацию в возрасте старше 35 лет приходится <10% случаев первичной лимфедемы. Обычно развивается на нижних конечностях [81].
1.3.2. Вторичная лимфедема
1.3.2.1. Лимфедема, связанная с лечением рака; эпидемиология по некоторым вмешательствам
Лимфаденэктомия (диссекция лимфатических узлов). Лимфаденэктомия, по всей видимости, наиболее ассоциирована с развитием лимфедемы. Это основная причина развития лимфедемы у пациентов с раком молочной железы, раком предстательной железы, раком эндометрия, раком шейки матки и меланомой [82–84]. Дополнительными факторами риска развития лимфедемы при хирургическом лечении любого рака являются локализация опухоли и раневые осложнения [26]. Частота развития РМЖ-ассоциированной лимфедемы по результатам анализа только проспективных исследований в систематическом обзоре DiSipio T. с соавт. составила в целом 21,4% (95%ДИ 14,9-29,8), у женщин, перенёсших диссекцию подмышечных лимфоузлов - 19,9% (95%ДИ 13,5-28,2, 18 исследований), а после биопсии сторожевого узла - 5,6% (95%ДИ 6,1-7,9, 18 исследований) [30]. Как было указано в разделе «Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)», объем диссекции лимфатических узлов существенно влияет на частоту развития лимфедемы. В крупном проспективном когортном исследовании частота развития лимфедемы в группе с удалением <5 лимфоузлов составила 3,3%, в группе с удалением ≥5 лимфоузлов составила 18,2% [27].
Лучевая терапия. В систематическом обзоре установлена существенно более высокая частота развития РМЖ-ассоциированной лимфедемы у пациенток, получивших лучевую терапию в дополнение к операции в сравнении с только оперативным лечением (41% и 17% соответственно) [85]. По некоторым данным, местные поздние лучевые повреждения органов и тканей грудной клетки обнаруживаются у каждой 4-й больной РМЖ из числа получивших курс лучевой терапии [38]. Лучевая терапия определена в качестве независимого фактора риска развития РМЖ-ассоциированной лимфедемы в исследовании 2023 г. Отношение шансов развития лимфедемы в сравнении с непроведением лучевой терапии составило ОШ = 3,7 (95% ДИ 2,3-6,1) [86].
1.3.2.2. Лимфедема, связанная с лечением рака; эпидемиология по типам рака
Заболеваемость лимфедемой, связанной раком, варьирует в зависимости от типа рака, применяемого лечения и методов диагностики. В систематическом обзоре, который включил 47 исследований (7779 пациентов), общая частота развития лимфедемы составила 15,5%, а в зависимости от вида и локализации опухоли частота развития лимфедемы составила: меланома 16% (верхняя конечность 5%, нижняя конечность 28%), гинекологический рак 20%, рак мочеполовой сферы 10%, рак головы/шеи 4%, саркома 30% [26]. По данным указанного систематического обзора, диссекция тазовых лимфатических узлов осложняется развитием лимфедемы в 22% случаев, а проведение лучевой терапии – в 31%.
Рак молочной железы. В систематическом обзоре, который охватил 72 исследования (29 612 пациенток), общая частота развития лимфедемы у пациенток после лечения рака молочной железы составила 16,6% (95% ДИ 13,6-20,2), а при анализе только проспективных исследований - 21,4% (95% ДИ 14,9-29,8) [30]. Наибольшая заболеваемость была в течение первых двух лет после постановки диагноза рака. При этом из женщин, у которых лимфедема развилась после удаления подмышечных лимфатических узлов, у ¾ манифестация лимфедемы произошла в течение 3 лет после операции. Снижению риска развития лимфедемы способствует применимая у некоторых пациенток тактика биопсии сторожевого лимфатического узла с отказом от диссекции аксиллярных узлов при отрицательном результате исследования [84]. Основные факторы риска развития лимфедемы при хирургическом лечении РМЖ [30]:
- Диссекция подмышечных лимфоузлов, ОР = 2.6;
- Мастэктомия, а не резекция молочной железы, ОР = 2.7 – 7.4;
- Ожирение, ОР = 1.4.
Ожирение как фактор риска развития лимфедемы после хирургического лечения РМЖ изучено в нескольких исследованиях. В исследовании Helyer L. отношение шансов развития лимфедемы у пациенток с ИМТ >30 кг/м2 и пациенток с ИМТ <25 кг/м2 составило ОШ = 2,93 (95% ДИ 1,03-8,31) [87]. Аналогичные данные получены в ряде других исследований [88,89]. Практически идентичные цифры получены в ретроспективном исследовании от 2023 г [86]. При многопараметрическом логистическом анализе предоперационный ИМТ ≥ 30 кг/м2 определял значительно больший риск развития лимфедемы, чем предоперационный ИМТ < 25 кг/м2 (ОШ = 2,9 (95%ДИ 1,6-5,5). Лимфедема чаще встречалась у больных с предоперационным ИМТ ≥ 25 кг/м2 (37,9%), чем среди лиц с предоперационным ИМТ < 25 кг/м2(23,3%), со достоверными различиями через 6-12 (χ2 = 23,2; P = 0,000) и 12-18 месяцев после операции (χ2 = 5,3; P = 0,022).
Таким образом, ожирение является независимым (самостоятельным) фактором риска развития лимфедемы у пациенток, прошедших лечение по поводу РМЖ.
Гинекологический рак. Частота лимфедемы нижних конечностей у пациенток с гинекологическим раком достигает 25% [26,90] и существенно разнится в зависимости от локализации рака [91]:
- Рак эндометрия: от 1 до 38 процентов
- Рак шейки матки: от 17 до 81 процента
- Рак вульвы / влагалища: от 6 до 75 процентов
- Рак яичников: от 5 до 21 процента
Рак мочеполовой системы. Частота лимфедемы нижних конечностей у пациентов с раком мочеполовой системы (рак мочевого пузыря, полового члена, простаты) составляет примерно 11%. Риск развития лимфедемы выше у тех пациентов, которым проведена расширенная диссекция тазовых лимфатических узлов (1,4% у пациентов со стандартной диссекцией и 8,8% у пациентов с расширенной), а также у тех, кто помимо хирургического лечения получает лучевую терапию [92,93].
Меланома. Лимфедема нижних конечностей, связанная с меланомой конечности или ее лечением обусловлена удалением пахового лимфатического узла или метастазированием в лимфоузел. Частота развития лимфедемы при меланомах различных локализаций составляет 16,3, при меланоме конечности составляет в среднем 28%, а при полной диссекции регионарных узлов достигает 42% - 46% [26,94].
Саркома Капоши. Саркома Капоши — редкая саркома сосудистого происхождения, которая может сопровождаться вторичной лимфедемой [95,96].
1.3.2.3. Филяриоз (филяриатоз)
По оценкам Центра по контролю и профилактике заболеваний США (The Centers for Disease Control and Prevention, CDC), лимфатическим филяриозом поражено более 120 миллионов человек в 72 странах, преимущественно в тропиках и субтропиках Азии, Африки, западной части Тихого океана и некоторых частях Карибского бассейна и Южной Америки [70]. Филяриоз распространяется от человека к человеку при укусах комаров. Для заражения требуются множественные укусы инфицированными комарами в течение длительного времени (месяцы и годы), поэтому туристы имеют очень низкий риск заражения. В последние годы филяриоз регистрировался в 24 субъектах Российской Федерации [97]. Как уже отмечалось выше, в разделе этиологии, в Российской Федерации филяриоз протекает атипично, с отсутствием в тканях половозрелых нематод и микрофилярий, вследствие чего болезнь не осложняется формированием лимфедемы [71]. Случаи паразитарной (филяриозной) лимфедемы В РФ носят завозной характер.
1.3.2.4. Другие виды вторичной лимфедемы.
Эпидемиологические данные по другим видам вторичной лимфедемы (ассоциированной с инфекцией, травмой, операциями, системными воспалительными заболеваниями и т.п.) крайне ограничены или отсутствуют.
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I89 Другие неинфекционные болезни лимфатических сосудов и лимфатических узлов
Этот раздел включает все варианты первичной и вторичной лимфедемы конечности, за исключением: врожденный лимфоотек (Q82.0); лимфоотек после мастэктомии (I97.2).
Q82.0 Наследственная лимфедема (врожденный лимфоотек).
Рассматривается в данных рекомендациях как лимфедема конечности взрослого с манифестацией в первые 2 года после рождения (врожденная лимфедема).
I97.2 Синдром постмастэктомического лимфатического отека
Включает вторичную лимфедему, ассоциированную с хирургическим лечением рака молочной железы.
1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Классификация лимфедемы
На сегодняшний день не разработана единая классификация лимфедем, учитывающая наиболее важные для клинической практики признаки. Разработка классификации лимфедем CEAP-L (по аналогии с классификацией хронических заболеваний вен CEAP) не завершена, перспективы неизвестны. В связи с этим при описании лимфедемы и формулировке диагноза обычно используется комбинация из нескольких классификаций: по этиологии, по возрасту на момент манифестации (для разграничения врожденной и не врожденной первичной лимфедемы) и по степени выраженности (по стадиям лимфедемы).
1.5.1.1. По этиологии.
По этиологии лимфедема конечностей делится на первичную и вторичную. Врожденная лимфедема определяется как лимфедема, которая присутствует при рождении или проявляется в возрасте до 1 – 2 лет. Врожденная лимфедема может быть как спорадической, так и семейной (в семье прослеживаются признаки наследования лимфедемы).
1.5.1.2. По степени выраженности. Стадирование лимфедемы.
- Рекомендуется при формулировании диагноза использовать стадирование лимфедемы в соответствии с классификацией Международного общества лимфологов (ISL) 2020 г.
0 стадия. Латентная или субклиническая стадия. Отек не определяется. Могут встречаться субъективные симптомы. На субклинической стадии, несмотря на отсутствие отека, может быть выявлено нарушение транспорта лимфы инструментальными методами (например, при лимфосцинтиграфии или ICG-лимфографии).
I стадия. Отек минимальный или незначительно выраженный. Отек может полностью или почти полностью регрессировать в возвышенном положении конечности или за время ночного отдыха. Возможно выявление «отека с ямкой».
II стадия. Выраженный отек. Отек не проходит полностью в возвышенном положении конечности. Характерен питтинг. Формируется фиброз (в течение стадии происходит изменение характеристик отека: трансформация «отека с ямкой» в отек без появления ямки при надавливании). Ограничение подвижности конечности в поздней части 2 стадии за счет пролиферации и избытка подкожной клетчатки и формирования фиброза.
III стадия. Элефантиаз («слоновость») конечности. Питтинг может отсутствовать. Характерны кожные осложнения, дальнейшая пролиферация жировой клетчатки и прогрессирование фиброза тканей.
УДД 5 УУР С [66,98]
Комментарий 1, классификация Международного общества лимфологов (International Society of Lymphology, ISL) 2020 г. Существуют различные системы классификации, используемые для описания степени выраженности лимфатического отека. Наиболее широкое распространение получила классификация Международного общества лимфологов. В рекомендациях ISL от 2020 г. предлагается деление лимфедемы по степени выраженности и основным клиническим особенностям на три клинических стадии (стадия 1, 2 и 3), а также выделение субклинической стадии (стадия 0) [98]. Это стадирование поддержано в консенсусном документе 2022 года [66]. Выявление на этой стадии патологических изменений при лимфосцинтиграфии и ICG-лимфографии не является критерием или предиктором перехода заболевания в скором времени в I стадию (формирование отека). Утверждается, что субклиническая стадия может длиться месяцы и годы [98]. В англоязычной литературе для обозначения «мягкого» отека с появлением ямки при надавливании и «плотного», когда ямка при надавливании не образуется, используются термины pitting edema и non-pitting edema. Здесь и далее в тексте рекомендаций в качестве аналогов используются сокращенные именования «отек с ямкой» и «отек без ямки».
Комментарий 2, другие классификации лимфедемы по стадиям. Стадирование лимфедемы в рекомендациях Международного общества лимфологов по существу соответствует распространенной в РФ классификации лимфедемы. Один из первых ее вариантов предложен Т.В. Савченко в диссертационном исследовании на соискание степени доктора медицинских наук в 1990 г.: предельно лаконичен и точно отражает суть клинических проявлений лимфедемы в зависимости от стадии: I стадия (преходящий отек), II стадия (постоянный отек), III стадия (фиброзно-склеротические изменения), IV стадия (слоновость). Усовершенствованные варианты представлены в работе JI.B. Поташовым, H.A. Бубновой и Р.С. Орлова 2002 года и в руководстве по ангиологии от 2004 г. под редакцией А.В. Покровского [5,99]. Модифицированный вариант включает характеристику основных патофизиологических изменений соответствующей стадии: I стадия (компенсации) — стадия начальных функциональных нарушений (преходящий отек конечности, который появляется к концу дня и проходит при отдыхе), II стадия (субкомпенсации) — утрата фазной сократительной способности и насосной функции лимфатических сосудов (постоянный отек), III стадия (декомпенсации) — стадия полной утраты сократительной функции лимфатических сосудов (постоянный плотный отек, деформирующий конечность) [5]. Менее практичная система деления лимфедемы по степени выраженности, также описанная в рекомендациях Международного общества лимфологов – деление по разнице объема больной конечности в сравнении со здоровой [98]:
− 1 степень (легкая) – увеличение объема конечности на < 20%;
− 2 степень (умеренная) – увеличение объема конечности на 20 - 40%;
− 3 степень (тяжелая) – увеличение объема более, чем на 40%.
Оценка может проводиться как с помощью различных методов волюметрии, так и с помощью измерения длины окружности конечностей на определенных уровнях. Для соотнесения разницы в окружности конечностей со стадией лимфедемы можно использовать градацию Американской ассоциации физикальной терапии (APTA) [100]:
− Легкая лимфедема (1 стадия) – разница в длине окружности < 3 см.;
− Умеренная лимфедема (2 стадия) – разница в длине окружности 3–5 см.;
− Тяжелая лимфедема (3 стадия) – разница в длине окружности > 5 см.
Данную градацию можно использовать только при одностороннем поражении. Градация степени выраженности лимфедемы в описанных системах условна, окончательно определяет стадию лимфедемы и степень ее выраженности врач, проводящий диагностику заболевания с учетом особенностей конкретного клинического случая.
Классификации, основанные на инструментальных методах визуализации лимфатической системы, гистологических изменениях лимфатического сосуда, генетического типирования в настоящее время не нашли широкого применения в практике в силу низкой доступности диагностических методов.
1.5.2. Формулировка диагноза.
При описании лимфедемы и формулировке диагноза целесообразно:
1. Обозначить этиологию лимфедемы: первичная или вторичная.
2. Уточнить этиологию лимфедемы.
2.1. Для первичной лимфедемы:
- указать примерный возраст пациента на момент манифестации лимфедемы; при врожденной лимфедеме достаточно указания «врожденная»;
- отметить наличие признаков наследования, если таковые выявлены (применим термин «семейная»);
2.2. Для вторичной лимфедемы:
- обозначить ассоциацию с основным провоцирующим фактором;
- указать примерную дату (год) манифестации лимфедемы.
3. Обозначить стадию лимфедемы. Для стадирования лимфедемы рекомендуется использовать градацию Международного общества лимфологов ISL 2020 г. (подробно рассмотрена в разделе «Классификация лимфедемы» / «По степени выраженности. Стадирование лимфедемы»).
Примеры формулировки диагноза:
- Врожденная лимфедема правой нижней конечности 2 стадии.
- Первичная лимфедема правой нижней конечности 3 стадии, манифестация в возрасте 18 лет.
- Врожденная семейная лимфедема обеих нижних конечностей; справа 2 стадии, слева 1 стадии.
- Рак левой молочной железы с метастазами в надключичные лимфатические узлы. Состояние после комплексной противоопухолевой терапии от 2020 г. Вторичная злокачественная лимфедема левой верхней конечности 2 стадии, манифестация в 2022 году.
- Вторичная лимфедема правой нижней конечности 3 стадии, ассоциированная с рецидивирующей рожей. Манифестация в 2014 году. Трофическая язва правой голени.
4. При наличии сопутствующей конкурентной патологии вен конечности описать ее с кодированием в классификации CEAP [101]. В случае вторичного характера лимфедемы, развившейся вследствие наличия венозной недостаточности, на первое место в диагнозе выносится описание венозной патологии с кодированием в классификации CEAP. Употребление термина «флеболимфедема» - на усмотрение врача, устанавливающего диагноз. Возможно как указание пораженной конечности в целом, так и указание вовлеченных в лимфедему регионов (стопа, голень и т.п.). При сочетании варикозного расширения вен и первичной лимфедемы очередность описания нозологий в диагнозе - произвольная.
Примеры формулировки диагноза:
- Первичная лимфедема правой нижней конечности 2 стадии, манифестация в возрасте 20 лет. Варикозное расширение вен правой нижней конечности Dxt: C2,3,A Ep As Pr:GSVa,GSVb LII дд.мм.гггг.
- Посттромботическая болезнь правой нижней конечности, Dxt: C3,4b,S Esi Ad P o:CFV,FV,POPV,PTV LII дд.мм.гггг. Вторичная лимфедема (флеболимфедема) правой нижней конечности 1 стадии.
Для кодирования патологии вен в классификации CEAP рекомендуется использовать онлайн генератор кода диагноза на сайте Ассоциации флебологов России [102].
5. При наличии осложнений лимфедемы со значимыми клиническими проявлениями (по оценке врача, устанавливающего диагноз) целесообразно вынесение осложнения в диагноз.
Пример формулировки диагноза:
- Первичная лимфедема правой нижней конечности 3 стадии, манифестация в возрасте 23 лет. Лимфорея.
1.5.3. Применимость классификации лимфедемы по возрасту на момент ее манифестации.
Длительное время было принято первичную лимфедему классифицировать в соответствии с возрастом, в котором впервые проявляются ее симптомы [2,79,103]:
- Врожденная лимфедема определяется как лимфедема, которая присутствует при рождении или проявляется в возрасте до 1 – 2 лет.
- Лимфедема praecox (лат., ранняя) проявляется в возрасте от 1 до 35 лет, чаще всего в период полового созревания, является наиболее распространенным типом первичной лимфедемы.
- Лимфедема tarda (лат., поздняя) проявляется в возрасте > 35 лет. Является наименее распространенным типом первичной лимфедемы.
В рекомендациях по лимфедеме Международного общества флебологов (UIP) от 2013 г. отмечается, что разделение лимфедемы по возрасту манифестации на раннюю (praecox) и позднюю (tarda) не имеет патофизиологического обоснования, устарело и не имеет значения для клинической практики [68]. В рекомендациях Международного общества лимфологов от 2020 г., Международном согласительном документе от 2022 г. описанная классификация не применяется, термины praecox и tarda не используются [66,98]. Диагностика и лечение для лимфедемы praecox и tarda не имеют различий. Границы между возрастными группами в указанной классификации условны и в разных руководствах приводятся в разных значениях. Например, в рекомендациях AVF 2017 года границей манифестации врожденной лимфедемы указан возраст в 2 года, а верхней границей лимфедемы praecox – 25 лет, при этом не указано, к какому типу отнести лимфедему с манифестацией в интервале от 25 до 35 лет, в то время как в рекомендациях Ирландии от 2022 г. граница для врожденной лимфедемы – 1 год, а разграничение между praecox и tarda проведено по возрасту 35 лет [67].
1.6. Клиническая картина заболевания и состояния (группы заболеваний или состояний)
1.6.1. Особенности клинических проявлений лимфедемы в зависимости от этиологии и патогенеза
Клинические проявления лимфедемы одной стадии, но различной этиологии, не имеют существенных различий
1.6.2. Особенности клинических проявлений лимфедемы в зависимости от стадии
Как указано в разделе «Классификация заболевания», клинические проявления лимфедемы конечностей различаются в зависимости от стадии заболевания [98,104]:
0 стадия. Латентная или субклиническая стадия. Отек не определяется. Могут встречаться субъективные симптомы. Выделение в классификации лимфедемы по степени выраженности латентной стадии имеет важное значение для раннего выявления лимфедемы у пациентов группы риска (см. раздел «Профилактика» / «Диспансерное наблюдение, ранняя диагностика и профилактика прогрессирования лимфедемы»). Раннее выявление и лечение лимфедемы может предотвратить ее прогрессирование и снизить негативные психосоциальные и функциональные последствия для пациентов. Выявление латентной стадии лимфедемы может быть затруднительно, так как клинические проявления лимфедемы на этой стадии отсутствуют, субъективные симптомы лишены специфичности, а методы инструментальной диагностики не стандартизованы в отношении выполнения и трактовки. Установление диагноза лимфедемы на субклинической стадии является прерогативой специалиста, занимающегося лечением пациентов с лимфедемой конечности, и осуществляется на основании совокупной оценки факторов риска, субъективных симптомов и данных инструментального обследования.
I стадия. Отек минимальный или незначительно выраженный. Отек может полностью или почти полностью регрессировать в возвышенном положении конечности или за время ночного отдыха. Характерно выявление «отека с ямкой». Симптом Стеммера может не выявляться или быть сомнительным, особенно в начале заболевания или при старте манифестации лимфедемы с проксимального отдела конечности. Отек может появляться только при нагрузке на лимфатическую систему и полностью исчезать в покое.
II стадия. Клинические проявления могут значительно меняться по мере прогрессирования заболевания в пределах 2 стадии. В целом характерен отек с ямкой, однако в поздней фазе этой стадии за счет формирования фиброза может определяться отек без ямки. Отек выраженный, не проходит полностью в возвышенном положении конечности. Характерен положительный симптом Стеммера. За счет отека, избытка подкожной клетчатки и формирования фиброза возможно ограничение подвижности конечности.
III стадия. Гипертрофия подкожной клетчатки, признаки фиброза подкожной клетчатки и трофические изменения кожи и/или наличие кожных осложнений лимфедемы являются отличительными признаками 3 стадии лимфедемы. Возможен элефантиаз («слоновость») конечности – крайняя степень пролиферации и гипертрофии подкожной жировой клетчатки. В связи с наличием фиброза подкожной клетчатки в некоторых участках конечности может определяться отек без ямки.
1.6.3. Осложнения лимфедемы
1.6.3.1. Неинфекционные осложнения
Неинфекционные осложнения лимфедемы разделяют на 5 категорий [105]:
I. Непосредственно вызванные лимфедемой.
II. Косвенно связанные с лимфедемой.
III. Связанные с заболеваниями, вызывающими возникновение лимфедемы.
IV. Лимфовенозного происхождения.
V. Связанные с лечением лимфедемы.
I. Неинфекционные кожные нарушения, непосредственно вызванные лимфедемой.
- Лимфедема рубра (Lymphedema rubra). Кожные изменения, характеризующиеся покраснением кожи, похожим на целлюлит. В отличие от целлюлита лимфедема рубра не имеет четких границ, локальной гипертермии и обычно исчезает в приподнятом положении ног. Причиной этого состояния предполагаются «провоспалительные» изменения, вызванные увеличением содержания белка в интерстиции. Так как бактериальная инфекция не является причиной лимфедемы рубра, антибактериальная терапия не должна применяться для устранения этого кожного изменения.
- Кожные фиссуры. Линейные дефекты кожи, возникающие вследствие потери ее эластичности и инфильтрации. Чаще всего фиссуры образуются в местах естественных складок кожи. Эти щелевидные изменения в коже могут быть поверхностными или глубокими, склонны к мацерации из-за накопления влаги. Они являются местами возникновения грибковой инфекции.
- Кожная лихенификация. Причиной является усиление выработки кератина в коже. Может усугубляться расчесыванием и трением.
- Папилломатоз. Доброкачественные опухоли из эпителиальной или соединительной ткани, растущие экзофитно, возникающие в результате хронического воспаления, связанного с лимфедемой. Размеры этих опухолей могут варьировать от нескольких миллиметров до нескольких сантиметров. Мелкий папилломатоз может занимать обширные участки кожи, распространяться на всю стопу, представляя собой так называемую «замшелую стопу». Множественный крупный папилломатоз, который в литературе описан как «лягушачья икра» так же может занимать обширные участки кожи, распространяясь на всю конечность.
- Нодулярный фиброз. Фиброзные изменения кожи, имеющие вид булыжной мостовой, связанные с хроническим воспалением в коже. При этом цвет кожи не изменяется.
- Лимфорея или кожно-лимфатический свищ. Просачивание лимфатической жидкости через поверхность кожи. Дренаж может быть обильным, вызывая мацерацию кожи и выраженный болевой синдром. Лимфорея у пациента с лимфедемой конечности может возникнуть как послеоперационное осложнение (например, в зоне диссекции лимфатических узлов, в зоне проведения каких-либо вмешательств на конечности, пораженной лимфедемой), а также как осложнение самой лимфедемы с истечением лимфы из лимфоцист. Во втором случае вследствие гипертензии в лимфатической системе кожные лимфатические сосуды расширяются с образованием лимфоцист (выглядят как пузырьки на поверхности кожи). При повреждении поверхности лимфоцисты происходит истечение лимфы.
- Трофические дефекты (эрозия, язва). Трофическая язва — дефект кожи и мягких тканей не заживший в течение 6 недель. При наличии или появлении язвенного дефекта у пациента с лимфедемой конечности необходимо исключить сопутствующую артериальную и венозную патологию как возможную причину язвообразования.
- Гиперкератоз – аномальное утолщение эпидермиса, характерно для лимфедемы нижних конечностей, редко для кожи верхних конечностей.
- Хилорея – осложнение лимфедемы, связанное с нарушением транспорта лимфы в области млечной цистерны. Может проявляться истечением молочно белого хилюса в области гениталий и нижних конечностей.
- Лимфангиосаркома. Редкая злокачественная опухоль, которая может возникнуть у пациентов с длительно существующей лимфедемой. Наиболее изученный и часто встречающийся тип лимфангиосаркомы – синдром Стюарта-Тривса. Его ранними признаками являются пурпурные пятна на коже, плотные подкожные узелки и образование язв, поздними – висцеральные метастазы. Дополнительная информация по лимфангиосаркомам и ссылки на литературные источники – в пункте «Лимфангиосаркома» раздела «Осложнения лимфедемы».
II. Неинфекционные кожные нарушения, косвенно связанные с лимфедемой.
- Дерматит, экзема;
- Повреждения от избыточного давления (имеется в виду избыточное давление на кожу в положении лежа за счет увеличенного веса конечности);
III. Кожные нарушения, связанные с заболеваниями, вызывающими возникновение лимфедемы.
- Длительно незаживающие хирургические раны;
- Раны вследствие лучевого воздействия;
- Трофические язвы, липодерматосклероз вследствие хронической венозной недостаточности (имеются в виду изменения кожи, характерные по клиническим проявлениям для ХВН и в первую очередь связанные с наличием хронической венозной недостаточности при наличии вторичной лимфедемы, опосредованной ХВН);
- Травматические раны.
IV. Кожные нарушения лимфовенозного происхождения (имеются в виду изменения кожи при наличии выраженной лимфедемы конечности и наличии значимого заболевания вен когда дифференцировать генез нарушений кожи по клиническим проявлениям невозможно)
V. Связанные с лечением лимфедемы.
- Повреждения от давления. Механическое повреждение кожных покровов, связанное с неправильным использованием компрессионных изделий, одежды или обуви;
- Контактный дерматит. Воспалительная реакция кожи, возникающая в ответ на прямое воздействие раздражающих веществ, в том числе местных форм лекарственных препаратов. Симптомы заболевания зависят от силы и характера воздействия. Это может быть покраснение кожи, сухость и трещины, отек, образование пузырей или покрытых струпом изъязвлений. Диагностика простого контактного дерматита и его дифференцировка от других дерматитов основана на выявлении связи возникновения этого состояния с воздействием на кожу пораженной области химического вещества.
1.6.3.2. Инфекционные осложнения
Инфекционные осложнения могут существенно усугубить течение заболевания, снизить качество жизни пациента, ускорить прогрессирование лимфедемы, привести к необратимому поражению лимфатического русла. Инфекционные осложнения лимфедемы склонны к рецидивированию. К инфекционным осложнениям относят:
- Рожа, другие инфекционные целлюлиты;
- Синдром рецидивирующего лимфангитического целлюлита (RLCS);
- Грибковые инфекции;
- Простой хронический лишай (Lichen simplex chronicus);
- Фолликулит;
- Лимфангит;
- Некротический фасциит.
Установлено, что наибольший риск возникновения инфекционных осложнений и их рецидивирования имеют пациенты с гомозиготой TT по TLR4 1363C>T, что может служить основанием для тестирования этого гена у пациентов с лимфедемой нижних конечностей с целью проведения ранней антибиотикопрофилактики [106].
Рожа, другие инфекционные целлюлиты. Рожа — это бактериальная инфекция, протекающая в острой (первичной) или хронической (рецидивирующей) форме с выраженными симптомами интоксикации и очагового серозного или серозно-геморрагического воспаления кожи (слизистых оболочек) [107–110].
Рожа – одно из самых частых инфекционных осложнений лимфедемы. В работе А.К. Фейсханова с соавт. заболеваемость рожей при первичной лимфедеме составила 38,5%, при вторичной 45,7%. Наибольшая заболеваемость была в группе с 3 стадией лимфедемы (65%). Среди лиц, страдающих 2 стадией лимфедемы, заболеваемость рожей составила 40% [111]. По другим данным рожа осложняет лимфедему в 20–30% случаев, при этом риск рецидива рожи очень высок и составляет более 50% в течение года после первого эпизода [112]. Диагноз в первую очередь основан на клинической картине: местных проявлениях (четко очерченная гиперемия кожи, боль, гипертермия, усиление отека) и системных признаках инфекции (высокая температура с внезапным началом, озноб) [113].
Острый бактериальный целлюлит – это инфекция дермы и подкожно-жировой клетчатки, характеризующаяся эритемой с нечеткими очертаниями, уплотнением, гипертермией и болезненностью [109,114]. Дополнительные клинические признаки могут включать появление «апельсиновой корки», образование булл, увеличение и болезненность лимфатических узлов проксимальнее области целлюлита, линейные эритематозные полосы, характерные для лимфангита. Наличие лихорадки не обязательно, по данным разных исследований встречается в 22,5–77,3% случаев. Еще одним характерным признаком целлюлита является медленный регресс симптомов болезни на фоне лечения и склонность к абсцедированию. Этиологические исследования показали, что стрептококк группы А (Streptococcus pyogenes) является наиболее распространенным возбудителем целлюлита, золотистый стафилококк встречается примерно в 15% случаев [115–120].
Грибковая инфекция. Является частым осложнением лимфедемы. По данным Baird J. с соавт. у 20% пациентов, страдающих лимфедемой, встречается грибок рода Trichophyton и у 25% - Candida [121]. Высокая частота возникновения грибковой инфекции связана в первую очередь с благоприятной влажной средой, которая создается в складках кожи и межпальцевых промежутках, а также со снижением местного иммунитета. В свою очередь грибковое поражение создает благоприятные условия для присоединения бактериальной инфекции, что усугубляет клиническую картину болезни и ухудшает прогноз.
Лимфангит. Лимфангит – поражение лимфатических сосудов, вызванное бактериальной инфекцией, чаще всего сопровождает целлюлит, усугубляя клинические проявления и приводя к прогрессированию лимфедемы. Вместе с лимфатическими сосудами в воспалительный процесс вовлекаются лимфатические узлы, что клинически проявляется их увеличением (лимфаденопатией). Посев крови чаще всего выявляет β-гемолитический стрептококк группы В и G [122]. Местные факторы, вызывающие нарушение кожного барьера (раны, язвенные дефекты кожи, дерматит, мацерация и грибковая инфекция стоп), могут увеличить риск развития целлюлита и соответственно лимфангита [109,123,124]. Лимфангит сопровождается гиперемией, болезненностью по ходу воспаленных лимфатических сосудов, высокой температурой тела (39—40°С), ознобами, слабостью, приводит к усилению отека конечности [122]. В случае филяриоза поражение лимфатических узлов является первичным, вызывая дилатацию лимфатических сосудов и формирование лимфедемы. Обнаружено, что лица, страдающие филяриозом больше подвержены инфицированию бактериальной флорой с частыми рецидивами лимфангита, целлюлита и рожи [125].
Некротический фасциит. Некротический фасциит – крайне редкое, но серьезное осложнение лимфедемы, представляет собой бактериальную инфекцию, возбудителями которой являются грамположительные бактерии (стафилококки и стрептококки), поражающую кожу и подкожно-жировую клетчатку, сопровождающуюся некрозом фасции и миозитом с быстрым нарастанием тяжелых клинических проявлений в формате тяжелого сепсиса с исходом в полиорганную недостаточность. Это неотложное состояние требует госпитализации в экстренном порядке с целью проведения срочного хирургического вмешательства – вскрытия и устранения нежизнеспособных тканей [126–128].
1.6.3.3. Лимфангиосаркома, другие злокачественные опухоли как осложнение лимфедемы
Осложнением длительно существующей лимфедемы может быть развитие злокачественной опухоли. По данным систематического обзора в структуре злокачественных новообразований, развившихся на почве хронической лимфедемы, 89,7% занимает лимфангиосаркома (синдром Стюарта–Тривса, СТС, Steward Treves syndrome), 10,3% - другие злокачественные опухоли [129]. Чаще всего лимфангиосаркома развивается после радикальной мастэктомии, особенно в сочетании с лучевой терапией [129–132]. В работе da Costa Vieira RA в 97,2% случаев лимфангиосаркома развилась у женщин, 95,6% из них перенесли мастэктомию [133]. По некоторым данным, заболеваемость лимфангиосаркомой составляет 1,6 на 100 000, из числа заболевших лимфангиосаркома развивается на верхней конечности в 25% случаев [130]. По данным систематического обзора СТС развивается в среднем через 14,9 лет после формирования лимфедемы, смертностью составляет 53,9% (n = 178/331), частотой ремиссии 16,1% (n = 53/331) [129]. Другие злокачественные новообразования, ассоциированные с лимфедемой, развиваются в среднем через 24 года после формирования лимфедемы, смертность 10,5% (n = 4/38), частота ремиссии 31,6% (n = 12/38). СТС и другие злокачественные новообразования, ассоциированные с лимфедемой, имеют 5-летнюю выживаемость 22,4% и 65,2% соответственно. Выживаемость у пациентов после операции удаления опухоли на ранней стадии была выше (медиана: 48 месяцев, 5-летняя выживаемость: 43,3%), чем после проведения лучевой терапии (медиана: 10 месяцев, 5-летняя выживаемость: 6,5%).
По данным работы с описанием случая и несистематическим обзором литературы по дерматологическим проявлениям синдрома Стюарта-Тривса средняя длительность заболевания лимфедемой на момент развития лимфосаркомы составила составило 10 лет (диапазон от 3 до 24 лет) [133]. Средний возраст начала заболевания составляет 61,2 года, в 85,9% случаев заболевание развивается у женщин. СТС начинается в среднем через 14,9 лет после манифестации лимфедемы со смертностью 53,9% и частотой ремиссии 16,1%. Другие злокачественные новообразования начинаются в среднем через 23,7 года после манифестации лимфедемы, со смертностью 10,5% и частотой ремиссии 31,6%. 5-летняя выживаемость при СТС и других злокачественных новообразованиях составляет 22,4% и 65,2% соответственно (P = 0,001) [129]. Лимфангиосаркома может развиться на фоне первичной или семейной лимфедемы [130,134].
Клинические проявления лимфангиосаркомы. Ранними признаками лимфангиосаркомы являются пурпурные пятна на коже, плотные подкожные узелки и образование язв, поздними – висцеральные метастазы.
В работе da Costa Vieira RA при лимфангиосаркоме в 68,4% поражения локализовались исключительно в руке или предплечье; в 81,2% имелись множественные кожные элементы, 67,4% кожных элементов были описаны как узелки или «опухоли»; возможны разные варианты окраски кожных элементов, но 53,4% описываются как фиолетовые / сине-красные / пурпурные; 33,4% были окружены ореолом экхимозов, 33,4% были с изъязвленными поражениями [133]. Вместе с тем проявления синдрома Стюарта-Тривса разнообразны и могут маскироваться под различные поражения кожи, например, под буллезную рожу. Многообразие кожных проявлений затрудняет диагностику лимфосаркомы. Как указывают авторы процитированной выше работы, в ряде публикаций саркома описывалась как желтоватый ореола вокруг поражения, напоминающего гематому при рассасывании, и частота такого вида лимфангиосаркомы достигает 33,4%.
Развитие лимфангиосаркомы следует заподозрить при появлении на конечности с лимфедемой одиночных или множественных кожных элементов любого вида и/или нетипичном течении кожных осложнений лимфедемы. При подозрении на развитие лимфангиосаркомы пациента следует направить к врачу-дерматовенерологу или врачу онкологу для определения необходимости и проведения биопсии кожных образований.
При подозрении на злокачественную лимфедему может потребоваться дифференциальная диагностика с лимфангиоэндотелиомой (редкая доброкачественная опухоль, формирующаяся за счет пролиферации лимфатических сосудов) [135].
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
2.1. Критерии установления диагноза (состояния)
В настоящее время критерии диагностики лимфедемы конечностей не определены [26,66,72,98,136].
- При установлении диагноза «лимфедема» конечностей рекомендуется оценить согласованность жалоб пациента, данных анамнеза заболевания, данных клинического осмотра и учесть наличие характерных объективных признаков лимфедемы
УДД 5 УУР С [26,72,98,136–140]
Комментарий. В проанализированной рабочей группой литературе в различной форме формулируется положение, что в постановке диагноза «лимфедема» врач должен основываться на сочетании данных анамнеза и характерных клинических признаков.
- Рекомендуется в качестве характерных для лимфедемы рассматривать следующие объективные признаки:
- Симптом Стеммера (Штеммера) [78,141,142];
- Отек распространяется на тыльную поверхность стопы/кисти (в крайних проявлениях иногда именуется как «дорзальный горб», «буйволиный горб») [143,144];
- Безболезненность отека (болезненность в зонах увеличения объема конечности характерна для липедемы) [78,98,144,145];
- «Квадратные пальцы» (только для нижних конечностей, boxcar toes – отек пальцев, придающий им форму прямоугольника в продольном сечении) [146];
- Асимметрия отека при билатеральном поражении конечностей [144,147].
УДД 5 УУР С [68,72,78,98,139,144,146–148]
2.2. Диагностика; общие положения
При любом одностороннем или двустороннем отеке/увеличении объема конечности необходимо рассмотреть возможность наличия лимфедемы.
У пациента с лимфедемой и онкозаболеванием в анамнезе помимо диагностики лимфедемы следует рассмотреть возможность развития лимфедемы за счет рецидива опухоли и необходимость обследования, направленного на исключение такого рецидива.
Итог, который можно подвести на основании изученной литературы: диагноз «лимфедема» является в первую очередь клиническим диагнозом, основанным на тщательно собранном анамнезе и физикальном обследовании, включающем измерение объема конечностей [26,98,136–140]. Внимательного сбора анамнеза и клинического обследования достаточно для установления диагноза лимфедема конечности в большинстве случаев [26,149]. Это положение поддержало 88% экспертов согласительного документа, не поддержало 12%, отметив достаточно высокую вероятность ложно-отрицательного результата клинической диагностики [66]. В заключении консенсусного международном документа по диагностике и лечению лимфедемы указано, что клиническое распознавание лимфедемы предпочтительнее инструментальной визуализации [66]. Использование инструментальных методов визуализации необходимо в некоторых случаях неясного диагноза и при планировании хирургического лечения [66,150,151]. Вместе с тем следует отметить, что подход к диагностике лимфедемы только на основании наличия объективных признаков, считающихся характерными для этой патологии, обладает серьезными недостатками ввиду низкой чувствительности, специфичности и прогностической ценности. В работе по оценке этих параметров в отношении основных диагностических признаков лимфедемы у пациентов с лимфедемой нижних конечностей (симптом Стеммера, «квадратные пальцы», отек тыльной поверхности стопы, отек без появления ямки при надавливании) установлена общая чувствительность данного набора признаков в 17% (только 17% пациентов с подтвержденной с помощью лимфосцинтиграфии лимфедемой имеют указанные клинические признаки) [148]. Специфичность составила 88%. Точность положительного прогноза (positive predictive value) составила 68%, точность отрицательного прогноза (negative predictive value) – 43%, общая точность перечисленных клинических симптомов как диагностического теста составила 47%, что подчеркивает сложность клинической диагностики лимфедемы. Только симптом Стеммера был статистически значимым независимым предиктором подтверждения лимфедемы с помощью лимфосцинтиграфии с отношением шансов ОШ= 7,9 (95% ДИ 1,3 – 46,3, p=0.02). Эти данные подчеркивают необходимость тщательного сбора и анализа жалоб и анамнеза заболевания для корректной интерпретации данных клинического обследования.
При сборе анамнеза, осмотре и физикальном обследовании необходимо сразу оценивать признаки, позволяющие провести дифференциальную диагностику с некоторыми распространенными заболеваниями, напоминающими лимфедему. Подробнее это положение раскрыто в разделе дифференциальной диагностики.
2.3. Жалобы и анамнез
Жалобы при лимфедеме не имеют специфичности. В большинстве случаев жалобы ассоциированы с латентным или физикально определяемым отеком (дискомфорт или боль в конечности, чувство отечности, тяжести, распирания и т.п.) и ограничением функции конечности (утомляемость, ограничение выполнения некоторых элементов повседневной активности (надеть бюстгальтер, завязать шнурки, помыть волосы, развесить белье после стирки и т.п.). Следует уделять повышенное внимание выявлению описанных симптомов (проводить активный сбор жалоб) у пациентов группы риска (см. раздел «Профилактика развития вторичной лимфедемы» / «Группы риска»).
2.4. Клиническое обследование
2.4.1. Анамнез
При сборе анамнеза необходимо обратить внимание на возраст, в котором произошла манифестация лимфедемы, области возникновения и распространения отека, хронологию прогрессирования проявлений лимфедемы, ассоциированные симптомы (дискомфорт, боль, ощущение отечности, тяжести, ощущения стеснения и др.), «медицинскую» историю (перенесенные инфекции кожи, противоопухолевая терапия, хирургические вмешательства), эпизоды значимого снижения подвижности (путешествия, иммобилизация) и семейный анамнез в отношении лимфедемы и липедемы, динамику отека в течение суток [144].
2.4.2. Осмотр и физикальное обследование
Диагностика лимфедемы на 2 и 3 стадии обычно не вызывает затруднений.
2.4.2.1. Признаки, характерные для лимфедемы.
При осмотре и физикальном обследовании следует определить наличие проявлений, относимых к характерным для лимфедемы (подробно рассмотрены в разделе «Критерии установления диагноза»:
- Симптом Стеммера (Штеммера);
- Отек на тыльной поверхности стопы/кисти;
- Безболезненность отека;
- «Квадратные пальцы» нижних конечностей;
- Асимметрия отека при билатеральном поражении конечностей.
При оценке наличия отека на конечностях на ранней стадии лимфедемы следует иметь в виду, что изначально отек может затрагивать только проксимальные или только дистальные отделы конечностей, а при РМЖ-ассоциированной лимфедеме может начаться на грудной клетке.
2.4.2.2. Симптом Стеммера.
Симптом Стеммера, он же симптом Капоши – Стеммера (Stemmer sign, Kaposi-Stemmer sign) [78,141,142]. Симптом Стеммера впервые описан Робертом Стеммером в 1976 году [141].
Описание симптома Стеммера. У здорового человека можно захватить в щипок и приподнять кожную складку на тыльной поверхности проксимальной фаланги пальцев стопы или на тыльной поверхности проксимальной фаланги пальцев кисти. В случае невозможности/сложности захвата кожи в указанных местах в складку или при утолщении складки по сравнению с той же областью здоровой конечности диагностируется положительный симптом Стеммера [78]. Симптом Стеммера является патогномоничным признаком лимфедемы. Отрицательный симптом Стеммера не исключает наличие лимфедемы. Отрицательный симптом Стеммера может быть при лимфедеме, начинающейся проксимально, а также на ранних стадиях лимфедемы. Положительный симптом Стеммера может определяться на любой стадии лимфедемы, ложноположительный симптом Стеммера определяется редко [78,142]. Как указано в разделе общих положений диагностики, симптом Стеммера является статистически значимым независимым предиктором подтверждения лимфедемы с помощью лимфосцинтиграфии с отношением шансов ОШ= 7,9 (95% ДИ 1,3 – 46,3, p=0.02) [148].
2.4.3. Измерения конечности
- Рекомендуется проводить количественную оценку отека конечности пациента с лимфедемой при постановке диагноза и в процессе лечения с целью установления диагноза, контроля выраженности лимфедемы и контроля эффективности лечения
УДД 5 УУР С [66,67,98]
Комментарий. Количественный контроль отека рекомендуется всеми профессиональными сообществами и в руководствах по лечению лимфедемы [67,72,98,139,144,149]. Необходимость количественной оценки отека конечности при лимфедеме поддержало 94% экспертов международного согласительного документа по диагностике и лечению лимфедемы [66]. Количественная оценка отека может проводиться с помощью измерения окружности конечности в определенных позициях или разными методами волюметрии.
2.4.3.1. Измерения окружности конечности
- Для количественной оценки отека конечности пациента с лимфедемой рекомендуется использовать измерение окружности конечности на разных уровнях.
УДД 4 УУР С [152,153]
Комментарий 1. Измерение окружности конечности является простым и недорогим способом количественной оценки выраженности отека, при этом он демонстрирует хорошую корреляцию с результатами волюметрии [152,153]. Измерения могут быть сделаны на любом уровне верхней или нижней конечности, если клиницист использует анатомические ориентиры для воспроизведения измерений. Как указано в разделе «Классификации лимфедемы», для соотнесения разницы в окружности конечностей со стадией лимфедемы можно использовать градацию Американской ассоциации физикальной терапии (APTA) [100]:
− Легкая лимфедема (1 стадия) – разница в длине окружности < 3 см.;
− Умеренная лимфедема (2 стадия) – разница в длине окружности 3–5 см.;
− Тяжелая лимфедема (3 стадия) – разница в длине окружности > 5 см.
Данную градацию можно использовать только при одностороннем поражении. Градация степени выраженности лимфедемы в данной системе условна, окончательно определяет стадию лимфедемы и степень ее выраженности врач, проводящий диагностику заболевания с учетом особенностей конкретного клинического случая.
Комментарий 2. Для упрощенной системы измерения длины окружности больной и здоровой конечности можно использовать предложения Международного консенсуса по лечению лимфедемы 2006 г. по проведению замеров в 4 точках [154].
Верхние конечности:
− Уровень пястно-фаланговых суставов;
− Запястье;
− 10 см. дистальнее локтевого отростка локтевой кости;
− 10 см. проксимальнее локтевого отростка локтевой кости;
Нижние конечности:
− Уровень пястно-фаланговых суставов;
− 2 см. выше медиальной лодыжки;
− 10 см. дистальнее нижнего полюса надколенника;
− 10 см. проксимальнее верхнего полюса надколенника.
Важнее не использование какой-то определенной системы, а фиксация в документации анатомических или топографических ориентиров проведения измерений для их воспроизведения в процессе контроля лечения.
2.4.3.2. Измерения объема
- При необходимости точной количественной оценки объема конечности рекомендуется рассмотреть применение методов волюметрии с вытеснением воды, оптико-электронной перометрии или рассчёт объема по методу усеченных конусов
УДД 5 УУР С [150,155]
Комментарий. Объем конечности может быть определен с помощью волюметрии с вытеснением воды, оптико-электронной перометрии и расчетом методом усеченных конусов или цилиндров [150,155]. При использовании волюметрии с вытеснением воды объем конечности может определяться либо прямым измерением, либо взвешиванием перемещенной воды. Метод громоздкий, требует специального оборудования. У пациентов с выраженными отеками, с ограниченной подвижностью конечности, воспалительными изменениями кожи применение этого способа становится проблематичным [150,156]. Для оптико-электронной перометрии используют специальные аппараты, представляющие из себя рамку, на сторонах которой расположены светоизлучающие диоды и сенсорные датчики. При измерении рамка на штативе перемещается вдоль и вокруг конечности. Полученная информация обрабатывается специализированным программным обеспечением [150,157–159]. Объем конечности можно рассчитать математическим методом усеченных конусов или цилиндров. Сущность способа заключается в измерении окружности конечности на разных уровнях с определенным интервалом в 2 или 3 см. Далее по формуле объема усеченного конуса рассчитывается объем сегмента конечности между соседними уровнями измерений. Для определения общего объема конечности необходимо сложить объемы всех сегментов. Точность этого способа зависит от соблюдения четких правил измерения лентой [160,161].
2.5. Лабораторная диагностика
- Не рекомендуется применение методов лабораторной диагностики с целью установления диагноза лимфедемы конечности или определения тактики ее лечения
УДД 5 УУР С [66–68,72,98,139,140,162]
Комментарий 1. В настоящее время не существует лабораторных показателей, которые применяются при установлении диагноза лимфедемы или влияют на тактику и методы ее лечения. Лабораторная диагностика не упоминается в существующих рекомендациях по диагностике и лечению лимфедемы. При выявлении признаков декомпенсированного сопутствующего заболевания целесообразно направить пациента к профильному специалисту для определения объема и характера требуемого дообследования и проведения лечения сопутствующей патологии.
Комментарий 2. В Ирландских рекомендациях по лимфедеме 2022 г. пациентам с ожирением и лимфедемой предлагается при необходимости и на основании данных сбора анамнеза и осмотра пациента оценить некоторые лабораторные показатели: клинический (общий) анализ крови с подсчетом всех клеток, креатинин сыворотки, альбумин, электролиты, гормоны щитовидной железы (в качестве общего скрининга можно использовать определение уровня ТТГ), АЛТ и АСТ. При признаках хронической сердечной недостаточности целесообразно выполнение ЭХО-кардиографии с оценкой фракции выброса и консультация кардиолога [72,163].
2.6. Генетическая диагностика
- Не рекомендуется проведение генетической диагностики с целью определения риска развития или тактики лечения лимфедемы конечностей
УДД 5 УУР С [66,67,98,162]
Комментарий 1. На сегодняшний день генетическая диагностика в отношении лимфедемы конечностей не влияет на практику профилактики и лечения и имеет значение для проведения научных исследований и разработки перспективных направлений профилактики и лечения заболевания. Генетическая диагностика не предлагается в составе алгоритма диагностики лимфедемы конечностей в рекомендациях профессиональных сообществ, не обсуждается в Международном консенсусном документе по профилактике и лечению лимфедемы 2022 г. и рассматривается в руководствах и рекомендациях как перспективное направление диагностики, требующее дальнейшей разработки [66,67,98,162].
Комментарий 2. Генетическая диагностика может использоваться при разработке перспективных направлений профилактики и лечения пациентов с лимфедемой конечностей. Панели для молекулярно-генетической диагностики первичной лимфедемы могут включать более 40 генов. Для пациентов с лимфедемой без признаков наследственных синдромов проводится тестирование на мутации в отдельных генах, ассоциированных с наиболее часто встречающимися подтипами первичной лимфедемы (ANGPT2, CALCRL, CELSR1, EPHB4, FLT4, GJC2, MDFIC, PIEZO1, TIE1, VEGFC) [11,19]. Тестирование на хромосомные аномалии и мутации в отдельных генах, ассоциированных с моногенными синдромами, проводится у пациентов, имеющих характерные дизморфизмы, врожденные пороки и задержки развития и другие клинико-фенотипические проявления [164,165].
Комментарий 3. Генетическая терапия перспективна в определении тактики лечения пациентов с лимфедемой конечности. Например, мутация FOXC2 приводит к дисфункции лимфатических клапанов с рефлюксом лимфы как основным механизмом формирования лимфедемы нижних конечностей. Это может быть причиной хорошего клинического ответа пациентов с таким типом нарушения на комплексную противоотечную терапию [11].
Комментарий 4. Генетическая диагностика преимущественно сфокусирована на первичной лимфедеме, однако недавние исследования показали перспективы выявления генетической предрасположенности к развитию вторичной лимфедемы после лечения РМЖ [166].
Комментарий 5. Генетическая диагностика может получить практическое применение при разработке эффективной таргетной терапии некоторых синдромов, ассоциированных с развитием лимфедемы, например, синдрома Нунан [167].
2.7. Инструментальная диагностика
2.7.1. Общие положения
- Рекомендуется рассматривать инструментальные методы диагностики лимфедемы как вспомогательные и необязательные методы подтверждения диагноза и определения характера и объема поражения лимфатической системы
УДД 5 УУР С [66]
Комментарий 1. Многие авторы считают, что постановка диагноза «лимфедема конечности» и контроль эффективности лечения в большинстве случаев не требуют применения инструментальных методов. В международном консенсусном документе по диагностике и лечению лимфедемы от 2022 года 88% экспертов согласились с утверждением, что для диагностики лимфедемы 2–3-й клинической стадии достаточно клинического осмотра, при этом 94% экспертов согласились с утверждением, что пациенты с лимфедемой должны иметь количественную оценку отека [66]. Следует отметить, что:
− не существует одного метода инструментальной диагностики, который дает ответы на все вопросы конкретной клинической ситуации (диагностика, стадирование, планирование вмешательства и т.п.);
− не существует метода инструментальной диагностики, который обязателен в диагностике и определении тактики лечения пациента с лимфедемой;
− трактовка результатов инструментальных исследований субъективна и неоднородна; использование одинаковых устройств и технологий разными авторами приносит различные, иногда диаметрально противоположные результаты, что может быть обусловлено особенностями подготовки персонала, настройки диагностических устройств, отсутствием стандартизации протоколов исследований и др.;
− все существующие методы визуализации лимфатической системы зависят от уровня технической оснащенности, биохимического дизайна и методов введения контрастов, от личного мастерства персонала с «интуитивным» учетом индивидуальных особенностей пациента [168].
Комментарий 2. В настоящее время нет прямых сравнительных испытаний, подтверждающих эффективность одного инструментального диагностического метода по сравнению с другим, хотя исследования продолжаются [162]. В рекомендациях секции онкологии Американской ассоциации физикальной терапии указывается, что на сегодняшний день не существует метода, который может быть использован как единственное средство диагностики вторичной лимфедемы верхних конечностей. При этом МРТ, КТ, лимфосцинтиграфия и лимфография, ввиду отсутствия качественной доказательной базы, отсутствия стандартизации, высокой стоимости и инвазивности, не рекомендуются к внедрению в повседневную клиническую практику [140]. Данные методы должны применяться ограниченно, по решению специалиста, занимающегося лечением пациента с лимфедемой. В некоторых рекомендациях профессиональных сообществ предлагается использовать лимфосцинтиграфию для установления факта нарушения работы лимфатической системы, а другие инструментальные методы (МРТ, КТ, УЗДС и др.) - для исключения патологии, сопровождающейся отеком конечности [98].
Комментарий 3. На сегодняшний день накоплены значительные данные о тесной связи хронической венозной недостаточности и нарушений лимфатического транспорта на основании лимфосцинтиграфии, непрямой лимфографии, магнитно-резонансной томографии и флуоресцентной визуализации лимфатических сосудов в ближней инфракрасной области [169–172]
- Не рекомендуется какой-либо метод инструментального исследования как обязательный и достаточный при подозрении на лимфедему или при установленном диагнозе лимфедемы для выявления или исключения патологии лимфатической системы или при планировании лечения.
УДД 5 УУР С [66]
Комментарий 1. Лимфосцинтиграфия на сегодняшний день считается «золотым стандартом» инструментальной диагностики первичной и вторичной лимфедемы. Однако это не означает обязательность выполнения лимфосцинтиграфии всем пациентам с лимфедемой. В консенсусном международной документе по диагностике и лечению лимфедемы от 2022 года за проведение лимфосцинтиграфии всем пациентам с предполагаемой или установленной лимфедемой проголосовало 42% экспертов, против – 58% экспертов [66]. Одним из главных аргументов против обязательного выполнения лимфосцинтиграфии явилось то, что результат исследования не влияет на тактику лечения пациента. В систематическом обзоре по сравнению лимфосцинтиграфии и МР-лимфографии указывается на взаимодополняющий характер этих методов и необходимости проведения исследований по оценке их влияния на клиническую практику [173]. В систематическом обзоре по оценке применения лимфосцинтиграфии для контроля результатов консервативного лечения лимфедемы верхних конечностей подчеркивается, что отсутствие стандартизации протоколов лимфосцинтиграфии и отсутствие консенсуса в трактовке ее результатов в настоящее время ограничивает использование лимфосцинтиграфии в качестве меры исхода лечения [174].
Комментарий 2. Определение необходимости инструментального исследования, выбор методов исследования являются прерогативой специалиста, занимающегося диагностикой и лечением пациента с лимфедемой. Выбор метода инструментального исследования определяется особенностями клинической ситуации, планируемым лечением, а также доступностью различных методов диагностики. Например, в последние годы при планировании хирургического вмешательства все шире применяется лимфография в ближнем инфракрасном диапазоне (NIR-лимфография). Магнитно-резонансная лимфография (МР-лимфография) дает подробную трехмерную информацию о расположении лимфатических сосудов и вен, о степени гипертрофии подкожной клетчатки и ее распределении, однако МР-лимфография не практична для планирования операции из-за ограниченной доступности и высокой стоимости [175].
2.7.2. Методы инструментальной диагностики
2.7.2.1. Ультразвуковое исследование.
Ультразвуковое исследование при лимфедеме может проводиться с целью выявления или исключения патологии вен конечностей, выявления иной патологии, сопровождающейся отеком или увеличением объема конечности, а также для оценки состояния мягких тканей перед началом и в процессе лечения лимфедемы (эхогенность кожи и подкожной клетчатки, наличие полостей свободной жидкости, дифференцировка кожного слоя (размытость границы кожи и подкожной клетчатки), толщина кожного слоя, подкожной клетчатки, глубокой фасции и мышечного слоя).
- Рекомендуется рассмотреть целесообразность выполнения дуплексного сканирования вен конечности при подозрении на лимфедему с целью выявления или исключения патологии вен конечности или магистральных вен
УДД 5 УУР С [66,98,140]
Комментарий. В номенклатуре медицинских услуг к исследованиям, предназначенным для выявления или исключения патологии вен, относятся:
− A04.12.005.004 Дуплексное сканирование вен верхних конечностей
− A04.12.006.002 Дуплексное сканирование вен нижних конечностей
− A04.12.015 Триплексное сканирование вен
− A04.12.015.001 Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное)
- Рекомендуется рассмотреть целесообразность выполнения ультразвукового сканирования мягких тканей вен конечностей при подозрении на лимфедему или при установленном диагнозе лимфедемы с целью выявления иной патологии, сопровождающейся отеком или увеличением объема конечности, а также для оценки состояния мягких тканей перед началом и в процессе лечения лимфедемы
УДД 5 УУР С [66,98,140]
Комментарий 1. В номенклатуре медицинских услуг к исследованиям, предназначенным для выявления патологии сопровождающейся отеком или увеличением объема конечности, а также для оценки состояния мягких тканей перед началом и в процессе лечения лимфедемы, относится: A04.01.001Ультразвуковое исследование мягких тканей.
Комментарий 2. В случае одностороннего поражения целесообразно фиксировать количественные показатели выявленных различий между здоровой и больной конечностью (например, различия в толщине кожного слоя, глубокой фасции, подкожной клетчатки, мышечного слоя). Измерения должны выполняться в фиксированных точках, обозначенных в протоколе результатов исследования. Ниже приведены предпочтительны следующие точки оценки состояния мягких тканей (датчик располагается перпендикулярно оси конечности).
Верхние конечности:
- средняя треть плеча - датчик по заднелатеральной поверхности середины плеча в поперечной плоскости;
- верхняя треть предплечья - датчик по заднелатеральной поверхности на 2,0 см дистальнее от головки лучевой кости локтевого сустава;
- нижняя треть предплечья - датчик по передней поверхности на 1,5 см проксимальнее от суставной щели лучезапястного сустава;
- кисть - датчик по передней поверхности кисти над серединой III пястной кости.
Нижние конечности:
- средняя треть бедра - датчик по передней поверхности середины бедра;
- верхняя треть голени - датчик на 2,0 см ниже головки малоберцовой кости по переднелатеральной поверхности голени;
- нижняя треть голени - датчик на 2,0 см выше суставной щели голеностопного сустава по передней поверхности;
- стопа - датчик по передней поверхности стопы над серединой III плюсневой кости.
Ультразвуковое исследование проводится на частоте от 3,5 до 20 МГц, предпочтительно использование линейного датчика с частотой в 7,5 МГц, а при значительно выраженном отеке сканирование глубоко расположенных тканей необходимо выполнять датчиком на 3,5 МГц [176]. В последнее время для визуализации подкожных лимфатических сосудов диаметром менее 30 мкм, а также лимфатического потока и лимфатических клапанов в отдельных сосудах стали использовать ультразвук ультравысокой частоты (UHFUS), работающий на частоте 70 МГц [177]. Лимфатические сосуды могут быть идентифицированы как прерывистые гомогенные, гипоэхогенные и зеркальные деформированные структуры. В отличие от кровеносных сосудов, лимфатические сосуды не спадаются при компрессии датчиком [178]. Ультразвуковое исследование можно использовать для визуализации лимфатических сосудов при операциях на ЛВА [179]
2.7.2.2. Лимфография цветная
- Не рекомендуется применение цветной лимфографии при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве метода диагностики
УДД 5 УУР С [66,98]
Комментарий. Цветная лимфография выполняется для визуализации лимфатических сосудов путем введения красящих средств. В настоящее время цветная лимфография используется как подготовительный этап при выполнении рентген-контрастной лимфографии для выявления лимфатического сосуда [180]. В клинической практике наиболее часто используется метод непрямой цветной лимфографии. При его выполнении краситель (трепановый синий, конго красный, синька Эванса) вводится в объеме 0,2-0,5 мл подкожно или внутрикожно с дальнейшим наблюдением его распространения по поверхностным лимфатическим сосудам. При прямой цветной лимфографии лимфатические сосуды можно инъецировать путем введения красителя внутрь лимфатического узла, используя чрескожный пункционный способ или открытый способ с выделением лимфатического сосуда или лимфоузла в операционной ране. Недостатками метода цветной лимфографии являются высокая травматичность, невозможность оценки глубоких лимфатических коллекторов, риском развития аллергических реакций, низкая точность и воспроизводимость метода
2.7.2.3. Лимфография флуоресцентная (ICG-лимфография, NIR-лимфография)
- Не рекомендуется применение флюоресцентной лимфографии в рутинной клинической практике при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве самостоятельного метода диагностики
УДД 5 УУР С [66,98]
Комментарий. Флуоресцентная лимфография является современной разновидностью цветной лимфографии с применением красителя индоцианин зеленый (indocyanine green, ICG, ICG-лимфография). Индоцианин зеленый имеет четко выраженный максимум поглощения в инфракрасной области при 800 нм в плазме крови или в крови, что позволяет выполнить лимфографию в ближнем инфракрасном диапазоне (near-infrared (NIR) lymphography, NIR-лимфография) [181]. С помощью этого метода была показана возможность визуализации аномальной лимфатической архитектуры и скорости лимфотока у пациентов с вторичной лимфедемой рук [182]. Благодаря высокому проникновению и низкому рассеянию света в ближнем ИК-диапазоне NIR-лимфография позволяет точно визуализировать лимфатические структуры на глубине до 2 см под кожей, и количественно оценивать сократимость собирательных сосудов с использованием ICG [183]. NIR-лимфография позволяет наблюдать различные модели обратного кожного лимфотока (всплеск, звездная пыль и диффузный), которые коррелируют с тяжестью лимфатической дисфункции и клиническими симптомами [184]. NIR-лимфография является быстрым, высокочувствительным, воспроизводимым методом, обеспечивающим точные детали анатомии лимфатических сосудов и функции лимфангионов, а также ответ на терапию [185]. Недостатки NIR-лимфографии заключаются в ограничении глубина визуализации (~ 2 см от поверхности кожи), нежелательных физико-химических свойствах ICG - плохая стабильность, самозатухание и низкий квантовый выход, что может быть преодолено только через разработку клинически одобренных контрастов, оптимизированных для лимфатической системы [186]. Учитывая ограничение глубины визуализации, для получения наиболее объективных результатов исследования до его выполнения необходимо убрать жидкостный компонент лимфедемы [186]. NIR-лимфография у пациентов с известной лимфедемой продемонстрировала чувствительность 1,0 и специфичность 1,0 по сравнению с КТ и МРТ и чувствительность 0,97, специфичность 0,55 и точность 0,82 при сравнении с лимфосцинтиграфией [187,188]. Метод может выполняться путем введения флуоресцирующего вещества непосредственно в лимфатический сосуд, визуализируемый после предварительного выполнения непрямой цветной лимфографии, либо путем внутрикожного введения вблизи области интереса, когда область интереса визуализируется с помощью камеры со связанным зарядом (coupled-charged detector, CCD).
2.7.2.4. Лимфография рентгеновская (рентгенолимфография)
- Рекомендуется рассмотреть целесообразность выполнения непрямой рентгеновской лимфографии для визуализации центральных лимфатических коллекторов и глубоких лимфатических структур при подозрении на наличие патологии грудного лимфатического протока, связанных с лечением или идиопатических скоплений лимфы различных локализаций - хилезный асцит, хилоторакс, хилурия и пр.
УДД 5 УУР С [66,98,140]
Комментарий 1. Лимфография (рентгеновская лимфография) является методом лучевой диагностики с прямой или непрямой визуализацией лимфатической системы с помощью рентгеноконтрастных препаратов. В настоящее время этот метод визуализации заменяется менее инвазивными методами, и используется в основном для визуализации центральных лимфатических коллекторов по определенным показаниям. Достоинством рентгенолимфографии является визуализация глубоких лимфатических структур, в том числе – грудного лимфатического протока, ятрогенных или идиопатических скоплений лимфы различных локализаций - хилезный асцит, хилоторакс, хилурия или лимфоцеле [189]. Недостатки метода двухэтапной и одноэтапной рентгенолимфографии: специальное обучение персонала (рентген-лаборанта, врача-радиолога и врача-хирурга), значительное время проведения, лучевая нагрузка на пациента, часто - необходимость местной анестезии и/или седации. Для повышения информативности метода была предложена рентгенотелевизионная лимфография. Серийные рентгеновские снимки (рентгенокинематография) с различными интервалами или в реальном масштабе времени (кино-, видеосъемка) позволяют визуализировать динамику транспортных процессов в лимфатической системе. При выполнении лимфографии возможна оценка состояния сократительного аппарата лимфатических сосудов путем определения формы лимфососуда и его сегментации на лимфангионы. При этом сегментация, имеющая форму «веретен» или «бус», свидетельствует о том, что сократительный аппарат сохранил свои функциональные свойства. Если сосуд не сегментирован и имеет форму «трубы» – это свидетельство утраты сократительной способности. Для оценки выраженности патологического процесса следует определять соотношение сегментированных сосудов к несегментированным [176]. Метод позволяет выявить уровень блокады лимфотока (дистальный, средний, проксимальный), его характер (полный, неполный), степень поражения лимфатических сосудов (гиперплазия, гипоплазия, аплазия) и другие симптомы (извитость лимфатических сосудов, ретроградный лимфоток, экстравазация). Нередко за рентгеновской лимфографией следует прямое хирургическое вмешательство с целью эмболизации места скопления или повреждения (подтекания) лимфы [190].
Комментарий 2. Современным вариантом рентгеновской лимфографии является метод непрямой лимфографии посредством создания депо неионного рентгеноконтрастного препарата (Iotasol, Iotrolan, Omnipak или их аналогов) в периферических тканях: 2 мл контрастного вещества вводится внутрикожно в межпальцевое интерстициальное пространство со скоростью 0,1 мл/мин в течение 20 минут (через иглу 24-27G) под рентген-контролем (с визуализацией сразу после начала введения препарата и на 5, 10, 15 и 30 минутах исследования, в переднезадней и боковой проекциях).
Комментарий 3. На сегодняшний день классическая двухэтапная прямая лимфография с жирорастворимым контрастным веществом считается устаревшей. При двухэтапном методе первым этапом для визуализации лимфатического сосуда внутрикожно в межпальцевое пространство стопы или кисти вводится краситель (чаще всего - метиленовый синий), вторым этапом лимфатический сосуд или лимфатический узел канюлируют и вводят йодсодержащий жирорастворимый контрастный препарат с последующей рентгенологической визуализацией - рентгеноскопия, рентгенография, рентгеновидеофиксация [191].
2.7.2.5. Рентгеноденситометрия
Рентгеноденситометрия (денситометрия, двухэнергетическая рентгеновская абсорбциометрия, Dual-energy X-ray absorptiometry, DXA, DEXA).
- Не рекомендуется применение рентгеноденситометрии в рутинной клинической практике при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве самостоятельного метода диагностики
УДД 5 УУР С [98,140]
Комментарий. Двухэнергетическая рентгеновская денситометрия (A06.03.061 Рентгеноденситометрия) не может использоваться в качестве диагностического инструмента при лимфедеме, но может использоваться при оценке соотношения объемов разных тканей конечности. При измерении пораженных и здоровых рук у пациенток с постмастэктомической лимфедемой выявили значительную разницу в жировой и мышечной массе (увеличение на 15%, p<0,0001), но только на 0,6% - изменение костной массы [192]. Исследования точности диагностики не проводились. Преимущества DXA - легко и быстро выполняется даже у пациентов с ослабленным здоровьем, у пожилых людей или пациентов с кожными проявлениями. Недостатки DXA включают воздействие радиации, стоимость стационарного оборудования исследовательского уровня [193].
2.7.2.6. Лимфосцинтиграфия
- Рекомендуется рассмотреть целесообразность выполнения лимфосцинтиграфии при подозрении на лимфедему для проведения дифференциальной диагностики при неясной клинической картине или при установленном диагнозе лимфедемы и наличии показаний к хирургическому лечению для определения его тактики
УДД 5 УУР С [66,98,140]
Комментарий 1. Лимфосцинтиграфия считается «золотым стандартом» в клинической визуализации для диагностики и стадирования лимфедемы. Вместе с тем, в консенсусном международной документе по диагностике и лечению лимфедемы от 2022 года за проведение лимфосцинтиграфии всем пациентам с предполагаемой или установленной лимфедемой проголосовало 42% экспертов, против – 58% экспертов. Одним из главных аргументов против обязательного выполнения лимфосцинтиграфии явилось то, что результат исследования не влияет на тактику лечения пациента [66].
Комментарий 2. Несмотря на плохое пространственное и временное разрешение и отсутствие стандартизации проведения, в диагностике лимфедемы лимфосцинтиграфия демонстрирует высокую специфичность (1,0), оценки чувствительности метода неоднородны: от умеренной (0,62) до высокой (0,96) [180,187,194].
Задачами лимфосцинтиграфии при лимфедеме являются [176]:
− оценка места введения препарата, количество, размер и время заполнения лимфатических сосудов; диагностика лимфатического блока;
− оценка симметричности и своевременности фиксации изотопа в лимфоузлах, их количество и форма; определение остаточной функции лимфатической системы;
− выявление коллатерального лимфотока и кожного рефлюкса, коллатерального заполнения лимфоузлов;
− оценка влияния лечения на транспорт лимфы.
Комментарий 3. Лимфосцинтиграфия не стандартизована (различные радиоактивные индикаторы и дозы радиоактивности, разные объемы инъекций, внутрикожные и подкожные или субфасциальные инъекции, одна или несколько инъекций, разные протоколы пассивной и активной физической активности, различное время визуализации, статические и/или динамические методы, и использование протоколов для глубокой системной визуализации и т.п.). Тем не менее, получаемые изображения дают широкое представление о лимфатических структурных аномалиях и дисфункциях: несмотря на низкое разрешение изображений, их качественный анализ дает информацию об асимметрии поглощения индикатора в лимфатических сосудах и лимфатических узлах здоровой и больной конечности, а также о наличии обратного кожного лимфотока [195]. Выделяют статическую и динамическую лимфосцинтиграфию. Первый вариант позволяет оценить морфологическое состояние лимфатических сосудов, а второй – определить выраженность дисфункции лимфатической системы. При выполнении динамической лимфосцинтиграфии используются различные упражнения, способствующие быстрому распространению радиопрепарата. Однако результаты динамической лимфосцинтиграфии полученные разными исследователями имеют большие отличия друг от друга. Это связано с тем, что используются различные радиофармпрепараты и различные схемы физической нагрузки [176]. Количественные и полуколичественные методы оценки транспорта лимфы (время исчезновения контраста в месте внутритканевой инъекции кинетика поглощения контраста лимфоузлами первого порядка и количественная оценка захвата трассера в конечностях) имеют диагностический смысл при коррекции результатов на динамику радиоактивного распада самого препарата. При внутрикожном введении препарата возможны ложноположительные результаты случайной пункции кровеносного сосуда. При выраженном фиброзе мягких тканей конечности возможна переоценка степени поражения лимфатической системы [196,197].
Комментарий 4. В клинической практике используются одобренные меченые технецием-99m (Tc99m) лимфатические специфичные индикаторы, различающиеся по размеру. Как правило в Европе это 99m Tc-наноколлоидный (диаметр 5–80 нм) сывороточный альбумин человека, в США - 99m Tc-серный коллоид (отфильтрованный до диаметра менее 100–200 нм), в Канаде и Австралии - 99m Tc-антимониевый коллоид-трисульфид (5–30 нм). В клинических исследованиях также использовались другие конъюгаты, такие как 99m Tc-фитатные частицы (10–20 нм), 99m Tc-иммуноглобулин (около 10 нм), 99mTc-декстран или целевые трейсеры, такие как 99mTc-тилманоцепт и 99mTc-ритуксимаб [198–203]. Для функциональной визуализации лимфатической системы предпочтительны индикаторы небольшого размера с быстрым диффундированием из депо в лимфатические сосуды [204]. Общепризнано, что трассеры размером от 10 до 100 нм подходят для лимфатической визуализации и что скорость их поглощения из места инъекции зависит от размера [205]. Поскольку «классическая» лимфосцинтиграфия дает 2D-изображения, то для точной анатомической локализации лимфатических аномалий используется технология ОФЭКТ/КТ, в которой сцинтиграфическое изображение с использованием препаратов на основе 99m-Tc сочетается с 3D-изображениями РКТ, достаточно точно отображающих локализацию радиоактивного сигнала по отношению к другим тканям [195,206].
- Не рекомендуется применение лимфосцинтиграфии с целью прогнозирования развития лимфедемы после хирургических вмешательств.
УДД 5 УУР С [66]
Комментарий. К настоящему моменту нет убедительных данных о прогностической значимости лимфосцинтиграфии в оценке рисков развития лимфедемы после диссекции лимфатических узлов. При этом, применение контрастного инъекционного метода с использованием радиоактивного изотопа сопровождается лучевой нагрузкой и имеет риски побочных эффектов, среди которых чаще всего встречались аллергические реакции, как системные, так и местные (эритема, крапивница, отек) [207].
2.7.2.7. Компьютерная томография (рентгеновская)
- Не рекомендуется применение компьютерной томографии в рутинной клинической практике при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве самостоятельного метода диагностики
УДД 5 УУР С [66,98,140]
- Рекомендуется рассмотреть целесообразность выполнения компьютерной томографии конечности при подозрении на лимфедему или при установленном диагнозе лимфедемы с целью выявления иной патологии, сопровождающейся отеком или увеличением объема конечности, а также для оценки состояния мягких тканей перед началом и в процессе лечения лимфедемы
УДД 5 УУР С [66,98]
2.7.2.8. Магнитно-резонансная лимфография бесконтрастная (бесконтрастная МР-лимфография)
- Рекомендуется рассмотреть целесообразность бесконтрастной магнитно-резонансной лимфографии при подозрении на лимфедему с целью дифференциальной диагностики или при установленном диагнозе лимфедемы с целью выявления и определения особенностей поражения лимфатической системы
УДД 1 УУР В [98,140,208]
Комментарий 1. Магнитно-резонансная лимфография (МР-лимфография), как бесконтрастная, так и с контрастированием лимфатической системы (с периферическими или интранодальными инъекциями) постоянно совершенствуются и все чаще используются в специализированных центрах по всему миру. Эти методы и специальные протоколы исследования обеспечивают изображения с высоким пространственным разрешением (охват больших анатомических областей, включая глубоко расположенные структуры - например, грудной проток) [140]. Основным преимуществом контрастной МР-лимфографии по сравнению с рентгеновской лимфографией является отсутствие ионизирующего излучения, по сравнению с лимфосцинтиграфией и NIR-лимфографией - более высокое разрешение. Бесконтрастная магнитно-резонансная лимфография (бесконтрастная МР-лимфография) является неинвазивным методом диагностики. Достоинствами бесконтрастной МРТ является ее неинвазивность, отсутствие риска аллергических реакций, умеренное временя визуализации. Основные недостатки бесконтрастной МРТ - высокая стоимость современных высокопольных и сверхвысокопольных МРТ-сканеров и их программного обеспечения, высокие затраты по техническому содержанию и обслуживанию оборудования. Применение методов МРТ в целом затруднено в связи с отсутствием стандартизации протоколов, наличием ограничений для пациентов с кардиостимуляторами, кохлеарными имплантами, металлическими протезами и имплантами.
Комментарий 2. МРТ-технологии исходно основаны на регистрации спектра ответа протонов (ядер водорода), включенных в молекулы воды и органические молекулы. Использование специализированных МРТ-последовательностей с подавлением сигнала от жира (STIR) сформировало направление бесконтрастной МР-лимфографии для визуализации лимфатических сосудов, лимфоузлов и центральных коллекторов лимфатической системы, и также зон формирования лимфедемы или лимфатических мальформаций любой локализации. По сравнению с МРТ с контрастным усилением, бесконтрастная МРТ позволяет визуализировать большее количество лимфатических сосудов [209]. По всей видимости это связано с изолированностью истоков лимфатических сосудов, вследствие которой введенный контраст может достичь только части лимфатических сосудов конечностей [210]. Хотя неконтрастная МРТ не дает никакой функциональной информации, анатомическая информация полезна в предоперационном периоде для определения мест трансплантации лимфатических узлов или подходящих мест для лимфовенозного анастомоза, наряду с картированием лимфодренажа [211,212]. Бесконтрастная МР-лимфография может быть полезна для оценки выраженности лимфатического отека [209].
Комментарий 3. Для изображений МР лимфографии ранних стадий лимфедемы характерны мало выраженные изменения. Это утолщение кожи и подкожной клетчатки, небольшая разница в площади поперечного сечения здоровой и пораженной конечности. Для ранних стадий лимфедемы фиброз не характерен. На более поздних стадиях четко визуализируется фиброз: концентрический или смешанный, идущий от фасции. При наличии выраженного фиброза визуализируется картина «ячеистого» типа с незначительным количеством жидкости. В некоторых случаях удается выявить субфасциальный локальный отек. При поздних стадиях лимфедемы магнитно-резонансная картина становится более яркой. Фиброзные разрастания образуют средне- и крупноячеистые «соты», причем, чем меньше фиброз, тем меньше размер ячеек, содержащих жидкость. Метод позволяет вычислять объем конечности, используя формулу усеченных конусов. Оценка степени увеличения объема должна выполняться путем сравнения со здоровой конечностью [176,213]. Пространственное разрешение современных МРТ-сканеров обозначено на уровне 100-500 микрон, поэтому бесконтрастная МРТ способна визуализировать афферентные лимфатические сосуды, диаметры которых «укладываются» в этот уровень размеров. Следовательно, их визуализация уже однозначно указывает на их расширение. МР-лимфография помогает идентифицировать афферентный лимфатический сосуд, а также экстравазацию контрастного вещества [214]. Поскольку содержимое лимфатических сосудов имеет крайне низкие скорости передвижения, то МРТ-технологии динамического анализа потока TOF и PHAS в этом отношении не подходят. Для измерения скорости лимфотока можно применить МРТ-технологии, используемые для количественной оценки тканевой перфузии [215]. Другой вариант — это МРТ с переносом насыщения химическим обменом (CEST) с использованием амидного переноса протонов (APT). В этом методе используется сигнал от протонов, связанных с амидными группами в эндогенных белках, что позволяет регистрировать обогащение белком соединительной ткани и интерстициальной жидкости, что является косвенным признаком лимфатической дисфункции при лимфедеме [216,217]. Дисфункция центральной лимфатической помпы (цикличность работы грудного и брюшных лимфатических протоков и cisterna chilii) может быть выявлена на технологиях кино-МР-лимфографии в «толстом срезе» (до 100-150 мм) в МР-протоколе сильно-взвешенного Т2-ВИ с подавлением жира в виде киносъемки длительностью до 5-7 минут со скважностью 5-90 секунд, с объемным разрешением 1-2 куб.мм [218,219]. МРТ является достаточно точным методом визуализации с метрической точки зрения. При сравнении размеров лимфатических узлов, определенных при биопсии, и размеров, полученных по МРТ визуализации, Установлено высокое соответствие результатов измерений размеров лимфатических узлов при биопсии и при МРТ-визуализации. При биопсии средние значения длинной и короткой оси лимфатических узлов составили 11,2 ± 5,3 мм и 7,3 ± 4,0 мм. соответственно, при МРТ 11,9 ± 6,0 мм. и 7,8 ± 4,6 мм. соответственно, число наблюдений более тысячи [220]. Судя по этим данным, морфометрические различия в пределах 0,5 мм (порядка 5% линейного размера) можно отнести на счет погрешности оператора по морфометрии, неполной компенсации артефактов движения (дыхания, сердцебиения), своеобразного отображения границ тканей на томограммах, и др.
2.7.2.9. Магнитно-резонансная лимфография контрастная (контрастная МР-лимфография)
- Рекомендуется рассмотреть целесообразность контрастной магнитно-резонансной лимфографии при подозрении на лимфедему с целью дифференциальной диагностики или при установленном диагнозе лимфедемы с целью выявления и определения особенностей поражения лимфатической системы
УДД 1 УУР В [98,140,208]
Комментарий 1. Weiss с соавторами при сравнении с лимфосцинтиграфией определили чувствительность и специфичность контрастной МР-лимфографии для выявления локальных лимфатических поражений (лимфоцеле, обратный кожный лимфоток) в 68% и 91% соответственно [221]. В систематическом обзоре контрастная МР-лимфография и лимфосцинтиграфия рассматриваются как взаимодополняющие исследования [208]. МР-лимфография облегчает оценку лимфатической системы в больших анатомических областях с отображением как поверхностных, так и глубоко расположенных структур. Лимфосцинтиграфия, при ограниченном пространственном и временном разрешении хорошо поддается количественной оценке с возможностью определения лимфатического транспорта по клиренсу изотопа. Контрастная МР-лимфография конечностей может быть полезна в стадировании лимфедемы, а также при предоперационном планировании лимфовенозных анастомозов, поскольку большое поле зрения позволяет визуализировать всю конечность и пространственно локализовать лимфатические и кровеносные сосуды в пределах здоровых и патологических структур, что облегчает выбор сосудов для анастомоза [222]. Из-за низкой молекулярной массы применяемых в клинической практике контрастных препаратов на основе Gd (<1 кДа) после интерстициального введения они абсорбируются не только лимфатической, но и кровеносной системами, что снижает специфичность этого метода визуализации: лимфатические сосуды нелегко разграничить от кровеносных сосудов на основании их анатомической структуры [223]. Для дифференцировки используется получение серии изображений. В лимфатических сосудах сигнал контраста увеличивается, а затем медленно затухает, а в кровеносных сосудах идет быстрое усиление сигнала, которое уменьшается с течением времени [224]. Поскольку эти данные затруднительно интерпретировать, то выполняется второй этап: этот же контрастный препарат вводят внутривенно, чтобы на МРТ-изображениях можно было четко различить кровеносные сосуды [225].
Комментарий 2. Контрастная МР-лимфография конечностей выполняется после интерстициальной инъекции контрастного вещества на основе гадолиния (Gd), обычно Gd-DTPA или Gd-DOTA, которое создает желаемый положительный сигнал на Т1-взвешенных томограммах. Благодаря контрастному усилению МР-сигнала снижаются требования к техническим параметрам МРТ-сканеров, что позволяет получить 3D-T1-WI томограммы зон поражения лимфедемой, оценить изменения лимфатических сосудов (расширения, извитости), а также определить расположение и протяженность обратного кожного лимфотока. Можно определить отношение лимфатических сосудов к другим анатомическим структурам и/или патологическим изменениям, возникающим в результате лимфедемы (накопление фиброзной и жировой ткани, утолщение подкожной клетчатки и кожи), полученным с помощью 3D-T2-взвешенных томограмм до применения контрастного усиления [226].
2.7.2.10. Биоимпеданс
- Не рекомендуется применение биоимпеданса в рутинной клинической практике при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве самостоятельного метода диагностики
УДД 5 УУР С [98,140]
Комментарий. Существует ряд методов оценки водных секторов организма, в т.ч. клеточной, внеклеточной и интерстициальной жидкостей, основанных на электрических свойствах биологических тканей, и объединенных термином «биоимпеданс». Разработка таких методов связана с потенциальной возможностью выявления отека без необходимости измерения объема конечности. К биоимпедансу относятся биоимпедансная спектроскопия (BIS), биоимпедансный анализ (BIA), диэлектрическая проницаемость тканей (TDC) и другие [98]. В основе использования биоимпеданса лежит зависимость величины электрического сопротивления от структуры биологических тканей, и в частности от объема содержащейся жидкости. Эти электрические свойства биологических тканей можно моделировать эквивалентными электрическими схемами. Биоимпеданс используется в виде одночастотных и многочастотных устройств для обнаружения и измерения жидкости в конечности, в том числе для обнаружения ранних накоплений тканевой жидкости. Соответственно, биоимпеданс может быть полезен в ранней диагностике лимфедемы для ее выявления на субклинической стадии [140]. Большинство исследований по биоимпедансу относятся к РМЖ-ассоциированной лимфедеме верхних конечностей. Формат использования биоимпеданса в диагностике латентной (субклинической) лимфедемы описан в разделе «Диспансерное наблюдение, ранняя диагностика и профилактика прогрессирования лимфедемы» главы «5. Профилактика и диспансерное наблюдение».
Несмотря на ряд исследований, доказывающих диагностическую эффективность биоимпедансной спектроскопии, в систематическом обзоре по ее применению сделан вывод об отсутствии данных по точности биоимпеданса и необходимости дальнейших исследований для стандартизации проведения и трактовки результатов [227]. Эти методы не упоминаются в рекомендациях по диагностике и лечению лимфедемы Американского венозного форума, а в рекомендациях The Dutch lymphedema guidelines названы «неадекватными» для повседневной клинической практики [67,139].
2.7.2.11. Изображение с 3D-камеры (3D-визуализация).
- Не рекомендуется применение методов 3D-визуализации при подозрении на лимфедему или при установленном диагнозе лимфедемы в качестве метода диагностики и контроля эффективности лечения
УДД 5 УУР С [140]
Комментарий. Визуализация с использованием трехмерных камер различными методами (6 цифровых однообъективных зеркальных камер, позиционный лазер, 3 камеры и инфракрасный датчик) применяется для создания трехмерной модели конечности и позволяет проводить измерения объемов. Несмотря на активное развитие этих технологий, на сегодняшний день отсутствует доказательства точности измерений, достаточные для рекомендации к клиническому применению. Данные технологии не упоминаются в актуальных рекомендациях профессиональных сообществ [66,67,98,139,140]. Существуют свидетельства, что 3D-визуализация, как правило, завышает измеряемый объем [228,229].
2.8. Дифференциальная диагностика лимфедемы и отеков иного происхождения
2.8.1. Общие положения по дифференциальной диагностике лимфедемы с другими состояниями.
2.8.1.1. Отек верхней конечности
Для дифференциальной диагностики отека (не гипертрофии) верхней конечности достаточно исключить венозный тромбоз и вовлечение магистральных сосудов в рубцовый процесс [144].
2.8.1.2. Односторонний отек нижней конечности
Односторонний отек нижней конечности у взрослого человека в первую очередь требует исключения острого окклюзионного венозного тромбоза как состояния, требующего незамедлительного проведения лечебных мероприятий. Другими причинами распространенного одностороннего отека нижней конечности являются:
- Посттромботическая болезнь;
- Хроническая нетромботическая проксимальная венозная обструкция (синдр. Мей-Тернера);
- Разрыв кисты Бейкера;
- Отрыв медиальной головки икроножной мышцы.
2.8.1.3. Двусторонний отек нижних конечностей
Наиболее частые причины двустороннего отека нижних конечностей [144,230–232]:
- Хроническая сердечная недостаточность;
- Хроническая венозная недостаточность (ХВН);
- Почечная или печеночной недостаточность;
- Гипопротеинемия;
- Гипотироз;
- Нефротический синдром;
- Идиопатические циклические отеки;
- Медикаментозные отеки;
- Гиподинамия, вынужденное положение, параличи (в т.ч. ДЦП), парезы.
- Ожирение.
Идиопатические циклические отеки. Причиной умеренного двустороннего отека нижних конечностей может быть синдром идиопатических циклических отеков, ассоциированный с менструальным циклом [233]. Этот синдром проявляется отеком не только нижних конечностей, но и лица, верхних конечностей. Идиопатические циклические отеки сопровождаются временным увеличением массы тела за счет патологической задержки жидкости. Примечательно, что идиопатические циклические отеки могут сопровождать лимфедему. В исследовании Pereira de Godoy с соавторами этот синдром выявлен у 9% женщин с лимфедемой нижних конечностей 2 степени [234]. Возможно, что состояние, именуемое «предменструальный синдром», включающее возможные отеки конечностей, лица и разных областей туловища, и циклические идиопатические отеки относятся к одному и тому же патологическому циклическому состоянию. В исследовании Tacani P. с соавторами отеки конечностей, лица или туловища встречались у 65% женщин, которым был установлен диагноз «предменструального синдрома» [232]. Для дифференциальной диагностики таким пациентам требуются внимательный сбор анамнеза, наблюдение, частый контроль веса в период диагностики для фиксирования его быстрых колебаний за счет колебаний задержки жидкости, дополнительные методы исследования. Диагностику и постановку диагноза проводит гинеколог или врач общей практики, задача специалиста по лечению лимфедемы – заподозрить наличие такого синдрома и подтвердить или исключить наличие лимфедемы.
Периферические отеки, вызванные лекарственными препаратами. Периферические отеки, вызванные лекарственными препаратами, плохо изучены, часто недооцениваются и неправильно диагностируются [235]. К наиболее часто используемым лекарственными препаратами, побочным действием которых являются периферические отеки, относятся блокаторы кальциевых каналов, в частности, нифедипин [236]. Появление отеков могут провоцировать нестероидные противовоспалительные препараты и неселективные антагонисты эндотелиновых рецепторов (применяются в терапии легочной артериальной гипертензии) [237,238]. Нужно отметить, что в случае побочного действия лекарственных препаратов существует достаточно чёткая причинно-следственная связь.
2.8.2. Дифференциальная диагностика лимфедемы конечности и некоторых состояний с отеком/гипертрофией конечности
2.8.2.1. Лимфедема конечности и хроническая венозная недостаточность
Верхняя конечность. Может потребоваться дифференцировка с ХВН на почве посттромботической болезни или стеноза подключичной вены. Ключевые пункты для дифференциальной диагностики:
- Анамнез (история тромбоза);
- Вовлечение кисти и пальцев, симптом Стеммера;
- Данные УЗДС вен конечности и подключичной вены.
Нижняя конечность. Дифференцировка с варикозной или посттромботической болезнью, ключевые пункты:
- Анамнез (история тромбоза);
- Вовлечение кисти и пальцев, симптом Стеммера;
- Данные УЗДС вен нижних конечностей, при необходимости – визуализация подвздошных вен и нижней полой вены (НПВ);
- Отсутствие характерной для ХВН гиперпигментации (дифференцировка с ПТБ, осложненной развитием трофических расстройств);
- Отсутствие варикозного расширения вен (дифференцировка с варикозной болезнью).
2.8.2.2. Лимфедема конечности и тромботические/нетромботические окклюзии глубоких вен конечности
- Ключевые пункты дифференциальной диагностики:
- Анамнез (острое или постепенное начало)
- Боль
- Данные УЗДС вен конечности, при необходимости – визуализация подвздошных вен и нижней полой вены (НПВ)/подключичной вены
2.8.2.3. Лимфедема и синдромы, сопровождающиеся гипертрофией конечности
Некоторые синдромы характеризуются разницей в объеме конечностей, которая может быть обусловлена гипертрофией мягких тканей (напр., синдромом Клиппеля-Треноне) или непропорциональным ростом части тела (напр., синдром Протея) в т.ч. идиопатическая гемигипертрофия и парциальный гигантизм [239]. В большинстве случаев такие синдромы имеют другие клинические проявления (в частности, сосудистые и пигментные пятна или увеличение не только ПЖК, но и всех тканей конечности, в т.ч. костной), которые позволяют верно оценить этиологию изменений конечности.
2.8.2.4. Лимфедема и микседема
Микседема (осложнение, крайняя форма гипотироза) проявляется отеками за счет задержки жидкости вследствие инфильтрации мягких тканей (в первую очередь кожи) гликозаминогликанами. Следствием является формирование отека без ямки. Характерно двустороннее поражение, отеки как нижних конечностей, так и лица и верхних конечностей. У 13% пациентов имеется сопутствующая эндокринная офтальмопатия. В типичных случаях претибиальной лимфедемы на коже обеих голеней появляются участки лилового, желтого, коричневого цвета.
Ключевыми отличиями от лимфедемы является одномоментный отек нижних и верхних конечностей, лица, формирование характерной для микседемы окраски кожи голеней.
2.8.2.5. Лимфедема и липедема
Липедема - хроническое заболевание, возникающее у женщин (крайне редко – у мужчин) преимущественно в период полового созревания или в момент гормональных изменений (беременность, менопауза), характеризующееся симметричным увеличением подкожной жировой клетчатки конечностей без вовлечения стоп, кистей и туловища, с болевым синдромом при касании (аллодиния) или с выраженным дискомфортом в области конечностей [240,241]. Липедема не является формой ожирения, но может сочетаться с ожирением. Пациенты с липедемой часто страдают от ожирения (50-85%), в этом случае отеки могут присоединяться как осложнение течения морбидного ожирения. Увеличение массы тела способствует ухудшению течения липедемы и усиливает симптоматику [241,242]. Липедема в чистом виде не сопровождается лимфатическими отеками, отсутствуют изменения, характерные для нарушения лимфатического транспорта на УЗ исследовании, МР и ICG лимфографии или лимфосцинтиграфии. Лимфедема не приводит к развитию липедемы.
Для липедемы характерно [240,241,243,244]:
- Женский пол;
- Начало в пубертатном периоде или в иной период гормональных изменений;
- Симметричное и двустороннее увеличение конечностей, диспропорционально туловищу;
- Не образуется ямка при пальпации/пальцевом тесте на определение характера отека;
- Симптом Стеммера отрицательный;
- Болевой синдром, болезненность и/или повышенная чувствительность; реже – выраженный дискомфорт в конечностях;
- Нет вовлечения стоп и кистей, резкий переход в области лодыжки;
- Нет существенной реакции на диеты и спорт (если индекс массы тела нормальный);
- Склонность к появлению кровоизлияний;
- Гипермобильность суставов;
- Нависающие «подушки» над коленными суставами.
Выделяют 5 типов липедемы по преимущественной локализации жировых отложений [240]:
1 тип. Ягодицы, область ТБС (тазобедренных суставов). В области ТБС преимущественная локализация жировой клетчатки - боковые поверхности, над большими вертелами бедренных костей);
2 тип. Ягодицы, область ТБС + бедра;
3 тип. Ягодицы, область ТБС + бедра + голени;
4 тип. Верхние конечности;
5 тип. Голени (от коленных до голеностопных суставов).
4 тип часто сочетается с 2 и 3 типом липедемы. Знание основных типов липедемы помогает в дифференциальной диагностике состояний, связанных с увеличением объема или отеком конечностей.
Основные признаки для дифференциальной диагностики лимфедемы, липедемы и ожирения представлены в Приложении А 3.1. «Дифференциальная диагностика лимфедемы, липедемы и ожирения».
3. Лечение, включая медикаментозную и немедикаментозную терапию
3.1. Цели лечения лимфедемы
Цели лечения лимфедемы:
- Восстановление (при наличии возможности) лимфатического оттока;
- Устранение или уменьшение лимфатического отека (уменьшение или нормализация объема пораженной конечности);
- Улучшение функции конечности;
- Устранение или уменьшение субъективных симптомов лимфедемы, уменьшение боли, ассоциированной с лимфедемой;
- Снижение риска инвалидизации;
- Повышение качества жизни;
- Профилактика развития инфекционных и кожных осложнений лимфедемы;
- Профилактика прогрессирования лимфедемы;
- Уменьшение проявлений лимфедемы (интегральная цель, включающая уменьшение объема, улучшение/восстановление функции конечности, уменьшение боли, ассоциированной с лимфедемой);
Целесообразно включение в программу лечения пациента с лимфедемой психологической поддержки и обучение пациента методам самолечения [66,72,98].
3.2. Общие положения, принципы и тактика лечения лимфедемы
3.2.1. Общие положения лечения лимфедемы
Лечение лимфедемы должно носить комплексный характер, иметь мультидисциплинарный подход и учитывать патогенез, патофизиологию и суть заболевания, быть направлено как на улучшение физических показателей, так и на повышение качества жизни. Необходимо учитывать, что лимфедема – это практически всегда хроническое заболевание, т.е. лечение и сохранение результата понадобится в том или ином объеме на протяжении всей жизни пациента вне зависимости от выбранных методов лечения.
Пациента необходимо в доступной форме информировать обо всех аспектах его заболевания, предоставлять обучающие материалы, формировать у него правильные ожидания результатов лечения и чувство ответственности за удержание результатов, делая его активным участником процесса лечения и обучая самостоятельным методам ухода (селф-менеджмент).
При выборе метода лечения необходимо руководствоваться особенностями диагноза (первичная/вторичная лимфедема, доброкачественная/злокачественная лимфедема, стадия, сопутствующая патология и пр.).
Пациентам с лимфедемой рекомендуется профессиональная помощь психотерапевта. Подробнее этот аспект рассмотрен в разделе «Медицинская реабилитация» / «Психологическая коррекция».
3.2.2. Основные принципы лечения лимфедемы
В лечении лимфедемы можно выделить три основных типа вмешательств (КФПТ, реконструктивная микрохирургия, резекционные операции) с различными возможностями и недостатками.
- КФПТ эффективно устраняет отек конечности (жидкостный компонент лимфедемы) и позволяет сохранить достигнутый результат, но не устраняет фиброз и избыточную жировую клетчатку и не восстанавливает лимфатическую систему;
- Реконструктивная микрохирургия - частично восстанавливает лимфатическую систему и уменьшает потребность в консервативной поддержке, но не устраняет фиброз и избыточную жировую клетчатку, не позволяет полностью отказаться от компрессионной терапии;
- Резекционные операции (например, липосакция) - устраняют нежидкостную часть лимфедемы (фиброз и избыточную жировую клетчатку), позволяют привести размер пораженной конечности к размерам здоровой, но не восстанавливают лимфатическую систему, нередко усиливают зависимость от компрессионного трикотажа.
Именно возможности и недостатки основных типов вмешательств определяют принципы их применения. Принципы применения основных типов вмешательств в лечении лимфедемы:
Консервативное лечение лимфедемы в виде КФПТ показано при отсутствии противопоказаний к ее компонентам пациентам с любой формой лимфедемы на любой стадии, так как только этот метод позволяет эффективно устранить жидкостный компонент лимфедемы, сохранить достигнутый результат, препятствует прогрессированию заболевания и уменьшает риск развития осложнений.
Если после устранения жидкостного компонента лимфедемы не удается сохранить достигнутый результат несмотря на поддерживающую терапию под контролем специалиста, или если пациент высказывает желание уменьшить зависимость от консервативной терапии для поддержания состояния без отека, необходимо рассмотреть выполнение реконструктивной операции на лимфатической системе после соответствующей диагностики состояния лимфатической системы и при условии соблюдении предоперационных и послеоперационных протоколов ведения пациента (Приложение А 3.7. Реконструктивные операции: особенности подготовки и послеоперационного ведения).
Если после устранения жидкостного компонента лимфедемы остается разница в объемах конечностей за счет фиброза и избыточной жировой клетчатки, которая снижает функцию конечности и/или качество жизни пациента, необходимо рассмотреть выполнение липосакции gри условии соблюдении предоперационных и послеоперационных протоколов ведения пациента (Приложение А 3.6. Липосакция: особенности подготовки, проведения и послеоперационного ведения).
Цели применения отдельных методов лечения и отдельных вмешательств, их эффективность и ограничения подробно рассмотрены в соответствующих разделах.
3.2.3. Критерии выбора тактики лечения, неэффективность консервативной терапии.
Консервативное лечение является основным (базовым) и обязательным видом лечения пациента с лимфедемой. Хирургические вмешательства являются возможным дополнением к консервативному лечению. Эффективное хирургическое вмешательство не отменяет необходимость проведения консервативного лечения и контроля состояния лимфедемы. Вместе с тем систематические обзоры показывают, что по мере совершенствования методов хирургического лечения лимфедемы отмечается повышение их эффективности [245,246]. Основанием для рассмотрения целесообразности выполнения реконструктивных операций является желание пациента снизить зависимость от компрессионной терапии для удержания результата лечения и рецидивирующая рожа, не поддающаяся медикаментозным способам профилактики.
Основанием для рассмотрения целесообразности выполнения липосакции и/или резекционных операций является желание пациента достигнуть одинаковых размеров конечности (если это недостижимо с помощью консервативного лечения из-за избыточного развития и фиброза подкожно-жировой клетчатки) и необходимость коррекции функции конечности.
Под неэффективностью комплексной физической противоотечной терапии понимается невозможность устранения жидкостного компонента лимфедемы или удержания достигнутого за время лечения результата при обязательном условии выполнения КФПТ опытными медицинскими специалистами и при условии точного соблюдения пациентом всех рекомендаций и режима лечения, в течение не менее 6 мес. В таких случаях целесообразно убедиться в достоверности диагноза (наличие именно лимфедемы, а не отеков другой этиологии), отсутствии присоединения осложнений и наличия злокачественной формы лимфедемы, а также в соблюдении всех принципов лечения при помощи КФПТ.
Необходимость направления пациента на консультацию по поводу целесообразности хирургического лечения определяет специалист, занимающийся лечением или наблюдением пациента с лимфедемой, с учетом особенностей клинического случая и доступности хирургического лечения. Пациент должен быть проинформирован обо всех возможностях улучшения его состояния вне зависимости от наличия специалистов по консервативному/хирургическому лечению лимфедемы в регионе проведения консультации.
3.3. Консервативное лечение лимфедемы
3.3.1. КФПТ: эффективность
3.3.1.1. Цели консервативной терапии лимфедемы, КФПТ.
Терапия лимфедемы направлена на достижение лучшей социальной, функциональной и психологической адаптации у пациентов. Целями консервативной терапии первичной и вторичной лимфедемы являются [66,68,98,139,144,247,248]:
- Устранение или уменьшение лимфатического отека (уменьшение или нормализация объема пораженной конечности);
- Профилактика прогрессирования лимфедемы;
- Устранение или уменьшение субъективных симптомов лимфедемы, уменьшение боли, ассоциированной с лимфедемой;
- Профилактика развития инфекционных и кожных осложнений лимфедемы;
- Улучшение функции конечности;
- Повышение качества жизни;
- Снижение риска инвалидизации;
- Поддержание достигнутых результатов лечения максимально длительное время.
- Уменьшение проявлений лимфедемы (интегральная цель, включающая уменьшение/нормализацию объема конечности, улучшение/восстановление функции конечности, устранение или уменьшение субъективных симптомов лимфедемы, уменьшение боли, ассоциированной с лимфедемой).
Для достижения указанных целей используется комплексная физическая противоотечная терапия (КФПТ, Complete Decongestive Therapy (CDT), Complete Decongestive Physiotherapy (CDP)).
- КФПТ рекомендована для пациентов с первичной и вторичной лимфедемой на любой стадии как эффективное средство консервативной терапии.
УДД 2 УУР В [249,250]
Комментарий. КФПТ рекомендуется как основа лечения пациентов с лимфедемой конечностей всеми профессиональными сообществами на основании большого числа исследований, доказавших ее эффективность [66–68,98,139,251–255].
3.3.1.2. Устранение или уменьшение лимфатического отека
- КФПТ рекомендована пациентам с первичной и вторичной лимфедемой конечностей с целью устранения или уменьшения лимфатического отека.
УДД 1 УРР A [255–263]
Комментарий. По данным проспективного исследования КФПТ позволяет добиться редукции отека при лимфедеме верхних конечностей на 59.1%, при первичной или вторичной лимфедеме нижних конечностей на 67.7% [255]. По данным обзора КФПТ позволяет добиться уменьшения объема лимфедемы на 45-70% [264].
3.3.1.3. Профилактика прогрессирования лимфедемы
- КФПТ рекомендована пациентам с первичной и вторичной лимфедемой конечностей с целью профилактики прогрессирования заболевания.
УУД 4 УУР С [98,139,265,266]
3.3.1.4. Устранение или уменьшение субъективных симптомов лимфедемы
- КФПТ рекомендована пациентам с первичной и вторичной лимфедемой конечностей с целью устранения или уменьшения интенсивности субъективных симптомов.
УДД 1 УУР B [98,252,255,263,267–270]
3.3.1.5. Профилактика или лечение поражений кожи и ПЖК
- КФПТ рекомендована пациентам с первичной и вторичной лимфедемой конечностей с целью профилактики и лечения поражений кожи и ПЖК.
УДД 4 УУР С [98,251,271–273]
3.3.1.6. Повышение качества жизни
- КФПТ рекомендована пациентам с первичной и вторичной лимфедемой как эффективное средство повышения качества жизни
УДД 2 УУР В [98,139,268,274–277]
3.3.2. КФПТ: компоненты
- Рекомендуется включить в КФПТ пациентов с первичной и вторичной лимфедемой конечностей следующие компоненты:
- Ручной лимфодренажный массаж (мануальный лимфодренаж);
- Компрессионная терапия;
- Физические упражнения;
- Уход за кожей.
УДД 3 УРР В [66–68,98,256,278,279]
Комментарий. В зависимости от особенностей конкретного случая, по решению специалиста, проводящего лечение пациента с лимфедемой, отдельные компоненты КФПТ или их комбинации могут применяться как самостоятельный вид лечения. Несмотря на то, что указанные компоненты КФПТ признаются обязательными в консенсусных документах и руководствах по лечению лимфедемы, роль отдельных компонентов при лимфедеме разного генеза и степени до конца не ясна и требует дальнейшего изучения. В рекомендациях AVF 2017 года на основании анализа 21 обзора по применению физикальных методов терапии лимфедемы отмечается, что КФПТ эффективна для уменьшения объема лимфатического отека, однако наиболее эффективные компоненты КФПТ не могут быть определены на основе актуальных фактических данных [67]. При этом в указанных рекомендациях КФПТ в составе: ручной лимфодренажный массаж, многослойное бандажирование, упражнения и уход за кожей рекомендуется с уровнем доказательности 1B по системе GRADE.
3.3.3. КФПТ: фазы
3.3.3.1. Показания и очередность фаз КФПТ
В большинстве случаев лечение пациента с лимфедемой конечности начинается с активной фазы КФПТ с последующим переходом в поддерживающую фазу. Показанием к проведению активной фазы КФПТ является наличие лимфедемы при первом обращении пациента, появление лимфедемы у пациента группы риска, усиление субъективных и объективных проявлений лимфедемы при диспансерном наблюдении или в поддерживающую фазу КФПТ. При малой выраженности отека, когда не требуется его активное уменьшение, лечение может начинаться с поддерживающей фазы (без проведения ручного лимфодренажного массажа и/или многослойного бандажирования конечности).
3.3.3.2. Технические цели
КФПТ проводится в 2 фазы – активная фаза (фаза интенсивной терапии) и поддерживающая фаза [66,68,98,139,253,278,280,281]. Основной технической целью активной фазы КФПТ является устранение или максимальное уменьшение отека конечности, основной технической целью поддерживающей фазы КФПТ является сохранение результата, достигнутого в активную фазу лечения [98,253,282–284].
3.3.3.3. Активная фаза КФПТ
Активная фаза КФПТ включает [285,286]:
- ручной лимфодренажный массаж;
- компрессионное многослойное бандажирование;
- физические упражнения;
- уход за кожей;
- обучение пациента и/или его родственников самостоятельной поддерживающей терапии.
- В активную фазу КФПТ рекомендуется проведение 3 – 6 процедур КФПТ в неделю на протяжении 1 – 4 недель без снятия компрессионных материалов в перерывах между процедурами.
УДД 5 УУР С [67,68]
Комментарий 1. Режим и продолжительность процедур КФПТ определяет врач, занимающийся лечением пациента с лимфедемой, с учетом выраженности отека и наличия осложнений. Оптимально проведение 5 – 6 процедур КФПТ в неделю. Недопустимо снятие компрессионных материалов в перерывах между процедурами.
Комментарий 2. Критерием возможности завершения активной фазу КФПТ и перехода к поддерживающему лечению является полное устранение отека конечности или прекращение его уменьшения. Для контроля уменьшения отека рекомендуется выполнение волюметрии конечности [68,98,139]. В повседневной практике с этой целью может применяться измерение окружностей конечностей [98,162,282].
Комментарий 3. В консенсусном практическом руководстве по лечению лимфедемы в отношении режима проведения КФПТ и мануального лимфодренажа предложен следующий режим проведения лечебных мероприятий: сеансы лечебных мероприятий в рамках курса (серии) могут проводиться от нескольких раз в неделю до нескольких раз в день; курсы терапии могут длиться несколько недель и могут повторяться с интервалом от трех месяцев до одного года [78]. Оптимальная частота и продолжительность сеансов и курсов КФПТ на сегодняшний день не установлены и определяются специалистом, проводящим лечение пациента с лимфедемой с учетом особенностей конкретного клинического случая.
Комментарий 4. Как показали РКИ, регулируемые компрессионные системы могут применяться в активную фазу КФПТ вместо многослойного бандажа [287,288].
3.3.3.4. Поддерживающая фаза КФПТ.
Поддерживающая фаза КФПТ обеспечивает поддержание достигнутых результатов лечения максимально длительное время и включает в себя:
- поддерживающая компрессионная терапия с помощью компрессионного трикотажа, регулируемых компрессионных систем или самостоятельного бандажирования;
- самомассаж (самостоятельный лимфодренаж, СЛД);
- физические упражнения;
- уход за кожей;
- контроль эффективности поддерживающей терапии со стороны специалиста.
- Рекомендуется проведение поддерживающей фазы КФПТ пациентом или его родственниками с целью сохранение результата, достигнутого в активную фазу лечения, при регулярном контроле эффективности терапии со стороны специалиста.
УДД 3 УУР В [253,255,278,282]
Комментарий. По данным проспективного исследования поддерживающая фаза КФПТ позволяет сохранить результат лечения. При наблюдении в течение 9 месяцев нарастание отека у пациентов, приверженных лечению (86%), не превысило 10% от объема устраненного отека, и составило 33% у пациентов, не приверженных назначениям [255].
- В поддерживающую фазу КФПТ рекомендуется контрольный осмотр специалиста с целью оценки эффективности терапии не реже 1 раза в год или при нарастании субъективных симптомов или отека
УДД 4 УУР С [282]
- В поддерживающую фазу КФПТ рекомендуется ношение компрессионных изделий ежедневно, максимально возможное количество времени, за исключением периода сна.
УДД 2 УУР B [66,289,290]
Комментарий. В определенных ситуациях компрессионная терапия может проводиться круглосуточно. Целесообразность, периодичность и критерии необходимости круглосуточного применения компрессионн6ых изделий определяет специалист с учетом особенностей клинического случая [290–292]. В поддерживающую фазу лечения пациентам с лимфедемой верхних и нижних конечностей не противопоказаны активные занятия спортом [293–295]. Во время контрольных осмотров специалист определяет необходимость и регулярность повторения активной фазы лечения для пациентов с лимфедемой верхних и нижних конечностей [259].
3.3.4. КФПТ: особенности при активном раке.
- Рекомендуется рассмотреть целесообразность проведения КФПТ у пациентов с активным раком с целью уменьшения симптомов и профилактики прогрессирования вторичной лимфедемы.
УДД 5 УУР С [98,296–299]
Комментарий. КФПТ может быть использована для облегчения симптомов (выраженного болезненного отека) и контроля вторичной лимфедемы при поражении лимфатических узлов и лимфатических сосудов первичной опухолью или метастазами. Лимфоотток не прекращается полностью в зоне опухоли, и нет данных о том, что КФПТ может способствовать метастазированию. КФПТ в этом случае может проводиться между курсами лучевой или противоопухолевой терапии [98,296,297]. В выводах исследования по КФПТ у пациентов с лимфедемой и активным локо-региональным раком, проведенного под эгидой Американского онкологического сообщества, указано, что такие пациенты могут получить пользу от КПФТ, физикальная терапия не должна быть ограничена из-за наличия или рецидива опухоли в дренирующем анатомическом ложе [296]. Вместе с тем, в ряде руководств рекомендуется не применять мануальный лимфодренаж в зоне расположения первичной опухоли или метастазов [78]. Окончательное решение о целесообразности и возможности проведения КФПТ при наличии у пациента активного рака принимает врач, курирующий лечение пациента с лимфедемой, с учетом особенностей конкретного клинического случая при условии наличия информированного согласия пациента.
3.3.5. КФПТ: противопоказания
Так как КФПТ является сочетанием нескольких компонентов, противопоказания к ним описаны в соответствующих разделах. Дополнительные ограничения на проведение КФПТ или ее компонентов определяются врачом, курирующим лечение пациента с лимфедемой, с учетом особенностей конкретного клинического случая.
3.3.6. КФПТ: МЛД (мануальный лимфодренаж) и СЛД (самостоятельный лимфодренаж)
3.3.6.1. МЛД: эффективность
Ручной лимфодренажный массаж (мануальный лимфодренаж, МЛД, manual lymphatic drainage, MLD) это специальный вид медицинского массажа, который представляет собой особую технику воздействия на пути лимфотока. МЛД может применяться как в составе КФПТ, так и в качестве самостоятельного метода лечения в определенных клинических случаях.
- Рекомендуется применение ручного лимфодренажного массажа в лечении пациентов с первичной и вторичной лимфедемой конечностей в составе КФПТ с целью уменьшения проявлений лимфедемы
УДД 1 УУР B [256,300,301]
Комментарий 1. Систематические обзоры по применению МЛД рассматривают только пациентов с РМЖ-ассоциированной лимфедемой. Доказательства эффективности МЛД получены только в систематических обзорах 2021 – 23 гг., включивших новые исследования по его применению. Ниже представлено резюме основных систематических обзоров по применению МЛД. Систематический обзор по МЛД от Кохрановского сотрудничества проведен в 2015 г., не обновлялся [302]. В него было включено 6 исследований (РКИ и «квази-РКИ») по применению МЛД при РМЖ-ассоциированной лимфедеме. В выводах авторы указали, что МЛД может принести дополнительную пользу к бандажированию конечности у пациентов с легкой и умеренной лимфедемой, и отметили крайнюю неоднородность и противоречивость данных по эффективности МЛД. С 2020 года эффективность МЛД была проанализирована в 5 систематических обзорах. В обзоре 2020 года, охватившем 17 РКИ, 8 из которых были включены в метаанализ (338 пациентов), сделан вывод, что МЛД не может значительно уменьшить или предотвратить лимфедему у пациентов после операции по поводу рака молочной железы [303]. В обзоре 2021 года проанализировано 10 исследований, авторы не смогли сделать положительный или отрицательный вывод об эффективности МЛД в отношении профилактики развития или уменьшения РМЖ-ассоциированной лимфедемы [304]. В том же году в другом систематическом обзор, охватившем 17 исследований (867 пациентки 2 пациента) показано, что есть доказательства эффективности МЛД в профилактике прогрессирования лимфедемы, развившейся после операции по поводу РМЖ, а также доказательства того, что МЛД усиливает эффект компрессионной терапии по уменьшению объема легкой лимфедемы. Однако этот эффект не был доказан для умеренной и тяжелой лимфедемы [256]. В систематическом обзоре 2022 года, охватившем 11 РКИ, из которых 10 включено в метаанализ, убедительно показана эффективность МЛД в профилактике развития РМЖ-ассоциированной лимфедемы и уменьшении болей у пациенток с такой лимфедемой [300] Относительный риск развития лимфедемы при использовании МЛД в сравнении с неприменением МЛД составил ОР = 0.58, (95%ДИ 0.37, 0.93), а снижение интенсивности боли СРС (стандартизованная разность средних) = -0.72 (95%ДИ -1.34, -0.09), однако изменения волюметрических показателей и качества жизни не были статистически значимыми. При этом в более позднем систематическом обзоре от 2023 года (457 пациентов) показано, что МЛД эффективен и в уменьшении объема конечности [301]. Объем верхней конечности уменьшался статистически значимо, но только при количестве сеансов лечения ≥20 или продолжительности лечения >2 недель.
Комментарий 2. Применение МЛД в составе КФПТ рекомендуется всеми основными профессиональными сообществами в мире. В частности, КФПТ с МЛД в составе рекомендуется Американским венозным форумом с уровнем доказательности 1B по системе GRADE [67]. МЛД указан как обязательный компонент КФПТ в последних рекомендациях Международного общества лимфологов [98]. В международном консенсусном документе по диагностике и лечению лимфедемы 2022 года достигнут консенсус по утверждению «Ручной лимфодренаж (МЛД) должен быть обязательным компонентом ведения пациентов с лимфедемой». При установленном критерии консенсуса в 70%, 70,2% участников дискуссии согласились с этим утверждением, 11% не согласились. Также консенсус достигнут по утверждению «Ручной лимфодренаж следует применять на ранних стадиях лимфедемы». 77% респондентов согласились с этим утверждением, 15% не согласились [66]. С учетом рассмотренных доказательств и сложившейся практики, в разделе комплексной физикальной противоотечной терапии мануальный лимфодренаж причислен к рекомендуемым компонентам КФПТ наряду с компрессионной терапией, физическими упражнениями и уходом за кожей.
Комментарий 3. При необходимости МЛД может применяться при лечении лимфедемы вне конечностей: лицо, туловище, молочные железы, гениталии [305–309]. Более того, в областях, где применение компрессии затруднено, МЛД может быть единственным способом уменьшить лимфатический отек [78].
- Рекомендуется применение ручного лимфодренажного массажа в составе КФПТ, в качестве самостоятельного метода или как дополнение к хирургическим методам лечения с целью профилактики развития вторичной лимфедемы, связанной с лечением РМЖ
УДД 1 УУР B [300]
Комментарий. Как отмечалось выше, в систематическом обзоре 2022 года, охватившем 11 РКИ (10 включено в метаанализ), убедительно показана эффективность МЛД в профилактике развития РМЖ-ассоциированной лимфедемы. Относительный риск развития лимфедемы при использовании МЛД в сравнении с неприменением МЛД составил ОР = 0.58, (95%ДИ 0.37, 0.93).
3.3.6.2. МЛД: технические особенности
Существует ряд различных техник и приемов выполнения МЛД и подобных физикальных методов (техники Vodder, Chikly, Leduс, MEM (Manual Edema Mobilization)) [310–312]. Наиболее распространена техника Vodder, основанная на 4х мануальных приемах («круг на месте», «прием вращения», «прием насоса», «прием черпака»), и имеющая 2 варианта исполнения (Vodder I для лимфедемы легкой степени и Vodder II для лимфедемы умеренной и тяжелой степени) [10,78]. Однако, нет доказательств преимуществ определенной техники или приемов МЛД в целом или для отдельных клинических показаний [78]. По существу МЛД — это мягкая техника массажа, направленного вдоль лимфатических путей. Классический массаж или растирание не приносят пользы при лимфедеме, более того, чрезмерно энергичное выполнение массажа любого типа может привести к увеличению нагрузки на лимфатическую систему за счет усиления кровотока или повредить лимфатические сосуды [66].
Общие аспекты выполнения МЛД [78]:
- обычная продолжительность одного сеанса - до 1 часа (может быть увеличена в связи с особенностями клинического случая);
- воздействие сначала проводится на не затронутых лимфедемой областях тела;
- воздействие смещается от проксимальных в дистальные отделы конечностей, чтобы подготовить проксимальные пораженные лимфедемой области к перемещению в них лимфы из дистальных отделов;
- направление выполнения лечебных приемов соответствует расположению лимфатических путей, коллекторов;
- суть лечебного приема заключается в умеренном растяжении поверхностных тканей (с созданием давления «вдоль», а не «вглубь») и чередовании фаз давления/расслабления;
- использует мягкое давление (если воздействие слишком сильное, оно стимулирует кровоток, появление гиперемии кожи и транспорт жидкости в ткани из сосудистого русла);
- движения медленные и ритмичные;
Базовая последовательность проведения МЛД:
- Шейная область (надключичная область, задняя шейная, затылочная, околоушная группы лимфоузлов, верхний край трапециевидной мышцы);
- Область живота;
- Передняя и задняя поверхности корпуса: приемы начинаются со здоровой группы лимфатических узлов, далее – дренаж здорового прилежащего квадранта по направлению к здоровым л/у, после – приемы в области анастомоза, затем дренаж пораженного квадранта в сторону здоровых л/у. «Глубокие техники» (парастернальные, паравертебральные, интеркостальные л/у) – при отсутствии противопоказаний (остеопороз);
- Отечная конечность. На пораженной конечности следует начинать с наиболее проксимальной области, постепенно смещаясь дистальнее, таким образом, охватывая все большую область. Вектор движений (вектор давления каждого приема) должен быть от дистальных участков к проксимальным.
Ограничения при проведении МЛД [10]:
- Недопустимо использование роллеров (LPG) и других вспомогательных механических средств или методов с интенсивным и грубым воздействием на ПЖК («антицеллюлитные» методы, «скульптурирующий массаж» и т.п.)
- Массаж не должен причинять боль;
- МЛД выполняется без использования специальных средств для массажа (кремов, масел и т. д.), так как важен непосредственный контакт руки массажиста с кожей пациента для выполнения правильной техники приемов.
3.3.6.3. МЛД: противопоказания
Противопоказания к проведению МЛД приведены в соответствии с актуальными консенсусными документами и руководствами по лечению лимфедемы [10,78,98].
Абсолютными противопоказаниями к проведению мануального лимфодренажного массажа принято считать:
- Тяжелая хроническая сердечная недостаточность (ХСН с низкой фракцией выброса, IIБ-III стадия, IV функциональный класс (NYHA IV));
- Острые инфекционные заболевания.
В нескольких экспериментальных работах показано, что МЛД, перераспределяя жидкость, имеет незначительное влияние на ее абсорбцию [313,314]. На основании этих данных в руководстве под редакцией В.В. Lee отмечается, что МЛД может применяться у пациентов с хронической сердечной недостаточностью без тяжелых клинических проявлений [144].
Относительными противопоказаниями к проведению мануального лимфодренажного массажа принято считать:
- Хроническая болезнь почек с умеренным и тяжелым снижением СКФ;
- Активное злокачественное новообразование.
Наличие онкологического заболевания в анамнезе (злокачественное новообразование в стадии ремиссии, неактивный рак) не является противопоказанием к выполнению МЛД. МЛД не увеличивает риск рецидива онкологического заболевания [98,296,297]. При активном онкологическом процессе МЛД может быть выполнена в качестве паллиативной помощи. При наличии кожных метастазов МЛД в зоне их расположения не проводится. Подробнее особенности проведения КФПТ при раке приведены в разделе «КФПТ: особенности при активном раке».
Местные противопоказания к проведению МЛД:
- Кожные метастазы в области проведения массажа
В области шеи:
- Наджелудочковые аритмии
- Гипертироз
- Гиперчувствительность каротидного синуса.
Глубокие техники в области живота:
- Беременность;
- Менструация;
- Радиационный колит или цистит;
- Болезнь Крона;
- Неспецифический язвенный колит;
- Кишечная непроходимость;
- Дивертикулит;
- Аневризмы сосудов брюшной полости;
- Цирроз печени (портальная гипертензия);
- Боли в животе неясного генеза;
- Тромбоз вен таза в анамнезе;
- Недавние операции в области живота.
3.3.6.4. СЛД (самостоятельный лимфодренаж)
Самомассаж (самостоятельный лимфодренаж (СЛД), «простой» мануальный лимфодренаж, simple lymphatic drainage (SLD), self-massage) – это упрощенная версия МЛД, которую пациенты и/или их родственники/опекуны могут освоить под руководством специалиста по КФПТ и применять самостоятельно для поддержания результатов [78,315,316]. В идеале все пациенты должны быть обучены СЛД, если к нему нет противопоказаний. Как и в случае с МЛД, существует мало надежных доказательств в поддержку использования и эффективности СЛД. Не существует общепризнанной техники для СЛД, но он похож на МЛД и проводится в течение 10-20 минут ежедневно [78].
3.3.7. КФПТ: компрессионная терапия
3.3.7.1. Компрессионная терапия: общие положения и цели
Виды компрессионной терапии, используемые в лечении лимфедемы:
- Компрессионное многослойное бандажирование (бинтование);
- Компрессионный трикотаж (круговой или плоской вязки);
- Регулируемые компрессионные (бандажные) системы.
Различные виды компрессионной терапии могут быть более или менее предпочтительны в зависимости от особенностей конкретного клинического случая. Выбор оптимального вида компрессионной терапии и определение режима ее применения является прерогативой специалиста, проводящего лечение лимфедемы данного пациента. В настоящее время только некоторые виды изделий для проведения компрессионной терапии внесены в номенклатурную классификацию медицинских изделий Минздрава России, в частности [317,318]:
- 364860 (трикотаж компрессионный/сдавливающий трубчатый); (6. Медицинские изделия для манипуляций/восстановления тканей/органов человека / 6.06. Повязки и сопутствующие изделия / 364860 Трикотаж компрессионный/сдавливающий трубчатый);
- 154040 (носки/чулки компрессионные, многоразового использования); (2. Вспомогательные и общебольничные медицинские изделия / 2.20. Носки/стельки медицинские / 154040 Носки/чулки компрессионные, многоразового использования);
- 263010 (носки/чулки компрессионные, одноразового использования); (14. Сердечно-сосудистые медицинские изделия / 14.23. Системы компрессии вен и сопутствующие изделия / 263010 Носки/чулки компрессионные, одноразового использования).
- Компрессионная терапия рекомендуется как основное средство профилактики и лечения первичной и вторичной лимфедемы в составе КФПТ, в качестве самостоятельного метода лечения или как дополнение к хирургическим методам лечения с целью профилактики развития лимфедемы, уменьшения или устранения субъективных симптомов и объективных проявлений лимфедемы, профилактики и лечения ее осложнений.
УДД 1 УУР A [66,319–321]
Комментарий 1. Компрессионная терапия может использоваться в качестве самостоятельного метода лечения при невозможности использования полноценной КФПТ из-за наличия противопоказаний к ее компонентам.
Комментарий 2. Эффективность компрессионной терапии в лечении пациентов с лимфедемой конечности доказана во множестве рандомизированных контролируемых исследований [320,322,323]. Вместе с тем, уровень доказательств эффективности различается для первичной и вторичной лимфедемы, для разных клинических исходов и разных компрессионных изделий или методов.
Комментарий 3. Клиническими целями компрессионной терапии при лимфедеме являются [10,66,67,98,140,324]:
− Уменьшение выраженности или устранение субъективных симптомов лимфедемы;
− Уменьшение лимфатического отека;
− Уменьшение проявлений фиброза подкожно-жировой клетчатки;
− Уменьшение проявлений липодерматосклероза;
− Профилактика прогрессирования лимфатического отека;
− Профилактика развития лимфатического отека после хирургических вмешательств на лимфатической системе;
− Профилактика и лечение трофических язв при лимфедеме;
− Повышение качества жизни за счет устранения или уменьшения субъективных симптомов лимфедемы и объективных проявлений лимфедемы;
− Снижение риска развития рожи.
3.3.7.2. КМБ (компрессионное многослойное бандажирование); общие положения
- Рекомендуется применение компрессионного многослойного бандажирования в лечении первичной или вторичной лимфедемы в составе КФПТ, в качестве самостоятельного метода лечения или как дополнение к хирургическим методам лечения в качестве элемента предоперационной подготовки и послеоперационного ведения с целью уменьшения лимфатического отека.
УДД 2 УУР А [10,66,67,98,325–327]
Комментарий. Наибольшую эффективность КМБ показало в составе КФПТ, однако применение его в качестве монотерапии также дает результат в виде значительного уменьшения отека. Возможность, целесообразность и безопасность применения КМБ как самостоятельного метода лечения определяет специалист, проводящий лечение пациента с лимфедемой, исходя из особенностей клинического случая.
- Для формирования многослойного компрессионного бандажа рекомендуется применение бинтов короткой или средней растяжимости, материалов для защиты кожи и костных выступов и материалов для создания цилиндрического профиля конечности
УДД 3 УУР B [328–331]
Комментарий. Бинты короткой растяжимости обладают особым преимуществом, так как обеспечивают высокое давление в ортостазе, во время ходьбы или иного движения (массажный эффект) и низкое давление в состоянии покоя (предпочтительное в покое, во время ночного отдыха и т.п.). Было показано, что правильно наложенный компрессионный многослойный бандаж с использованием бинтов низкой растяжимости создает давление на голень 50-60 мм.рт.ст. в положении лежа и 70-80 мм.рт.ст. в положении стоя. Даже если он наложен неплотно (если его выполнял, например, неопытный специалист) может быть достигнуто давление 30 мм.рт.ст. в положении лежа и более 40 мм.рт.ст. в положении стоя. Следует отметить, что оптимальное давление, которое должен создавать КМБ, до настоящего времени не определено.
- При проведении компрессионного многослойного бандажирования пациентам с выраженным исходным отеком в первые дни лечения рекомендуется замена компрессионных бандажей ежедневно или через день без снятия компрессионных материалов в перерывах между процедурами
УДД 5 УУР С [332,333]
Комментарий. Из-за быстрого и значительного уменьшения объема отека в течение первых 1-2 недель активной фазы КФПТ предпочтительна ежедневная оценка состояния конечности и смена бандажей. В некоторых ситуациях допустима боле редкая смена бандажей. Исследования показали, что давление под повязкой может значительно снизиться в первые три часа после наложения повязки, а клинический опыт показывает, что наибольшее уменьшение отека происходит в первую неделю лечения. Определение частоты смены бандажей является прерогативой специалиста, проводящего лечение пациента с лимфедемой.
3.3.7.3. КМБ: технические особенности
В лечении лимфедемы рекомендуется применять именно многослойный бандаж, первый и второй слой обеспечивают защиту и изоляцию кожи (эмоленты, раневые покрытия, трубчатый хлопчатобумажный бинт), третий слой формирует правильный контур конечности, обеспечивает защиту костных выступов (ватные бинты, поролон, прокладки из различных материалов), четвертый слой обеспечивает необходимое давление (один или несколько слоев эластичных бинтов короткой и/или средней растяжимости) [10,330,331,333–335]. Требуется индивидуально подбирать компоненты и силу наложения компрессионного многослойного бандажа, учитывая окружность конечности, консистенцию тканей, подвижность пациента, наличия у пациента других особенностей и хронических заболеваний. К сожалению, оценка всех особенностей бандажирования отдельных случаев не поддается стандартизации и проводится эмпирически. Поэтому целесообразно, чтобы наложение многослойного компрессионного бандажа проводил или контролировал специалист, имеющий большой опыт в лечении лимфедемы и проведении компрессионной терапии. При неправильном наложении КМБ может быть не только бесполезным, но и вести к осложнениям. По данным ряда исследований даже опытные врачи, лечащие лимфедему, испытывают трудности с правильным наложением бандажей [10,331]. Большинство экспертов в лечении лимфедемы (в том числе и основатели комплексной физической терапии М. Фёльди и Э. Фёльди) склоняются к следующему алгоритму наложения компрессионного бандажа [10].
1 слой, уход за кожей и дефектами кожи. В первую очередь, до наложения компрессионного бандажа, следует тщательно оценить состояние кожи. Кожу следует осматривать перед каждым наложением бандажа, особое внимание должно уделяться состоянию кожи между пальцами, в области суставов, в кожных складках. В случае неповрежденной кожи ее необходимо увлажнить и смягчить кремом-эмолентом. При лечении участков с гиперкератозом следует избегать агрессивной обработки из-за повышенного риска инфицирования. При наличии папиллом, лимфоцист, язв и других повреждений кожи необходимо осуществить уход за этими участками. Язвы и другие дефекты кожи требуют особого внимания. Клиницисты должны выбрать защитное покрытие, соответствующее характеристикам раны, обращая особое внимание на объем экссудата, болезненность и проявления дерматита. Уменьшение отека обычно способствует заживлению дефектов кожи.
2 слой, защищающий и изолирующий. После использования смягчающего средства на кожу накладывается хлопчатобумажный трубчатый бинт. Это защищает кожу и поглощает пот и избыток влаги. Бинт должен быть достаточно длинным, чтобы его можно было откинуть поверх основного слоя как на руке, так и на ноге, а также в паху или подмышечной впадине (чтобы предотвратить натирание чувствительной кожи).
3 слой, заполняющий, формирующий. Чтобы уменьшить или предотвратить отек пальцев кисти или стопы, их следует забинтовать эластичными мягкими бинтами шириной 4, 6, 8 см в несколько слоев по длине каждого пальца, начиная дистально и заканчивая проксимально. Если пальцы ног маленькие, бинт можно сложить до 2-2,5 см в ширину. Закрепить без излишнего давления на запястье или стопе. Заполняющий слой используется для уменьшения риска повреждения кожи и мягких тканей под давлением. Наиболее уязвимые (выступающие) точки (ахиллово сухожилие, тыльная сторона стопы, передний край большеберцовой кости, лодыжки) могут потребовать дополнительной защиты. Также этим слоем создается правильный профиль бинтуемой конечности: цилиндрической формы в поперечном сечении и конической формы по длине конечности, формируется ровная поверхность для наложения компрессионных бинтов. Для этих целей используются ватные бинты, поролон, прокладки из различных материалов. Сформированный профиль позволяет равномерно распределять давление по окружности поперечного сечения и обеспечить градиент давления с его уменьшением от дистального отдела конечности к проксимальному.
4 слой, компрессионный. Далее накладываются бинты короткой растяжимости в один или несколько слоев, которые создают малорастяжимую оболочку конечности. Допустимо использовать технику «елочка», «спираль» и их комбинации. Важным элементом правильной техники бандажирования является создание равномерного градиента давления (уменьшение давления бандажа от дистальных отделов к проксимальным).
После наложения компрессионного бандажа необходимо оценить диапазон движений. Пациент должен быть способен осуществлять движения во всех суставах, находясь в бандаже. Поэтому при бандажировании конечность должна находиться в положении легкого сгибания, а не полного разгибания. Изменение положения конечности или мышечная активность изменяет геометрию конечности, увеличивая давление под малорастяжимой повязкой. Эта сила направляется обратно внутрь конечности, оказывая воздействие на ткани и влияя на венозную и лимфатическую гидродинамику. В состоянии покоя и во время мышечной диастолы давление снижается, позволяя лимфатическим сосудам наполняться. Ходьба или иная активность конечности обеспечивает постоянное изменение геометрии конечности в замкнутом объеме жесткого, малорастяжимого бандажа, постоянное изменение давления и эффект «помпы» или «массажа» с усилением выведения лимфы из конечности. Повязки обычно накладываются на всю конечность, и любая частичная повязка должна выходить за пределы области отека и охватывать коленный или локтевой сустав, чтобы предотвратить проксимальное перемещение жидкости в сустав. Для предотвращения дистального отека на тыльной стороне стопы или кисти требуется создания повышенного давления в этой области наложением большего числа слоев или большим натяжением компрессионных бинтов. Однако объем бандажа на стопе не должен существенно затруднять ходьбу, поскольку нормальная походка имеет решающее значение для эффективной работы мышц голени. При появлении сильного дискомфорта и болевых ощущений можно рекомендовать пациентам снять верхний слой неэластичных бинтов. На выбор материалов для компрессионного многослойного бандажирования могут влиять стоимость, доступность, возможность стирки и повторного использования, а также личные предпочтения.
Основные компоненты КМБ представлены в Приложении А3.2 «Основные компоненты компрессионного многослойного бандажа».
- При наложении компрессионного многослойного бандажа рекомендуется формировать градиент давления (равномерное уменьшение давления бандажа от дистальных участков к проксимальным) с целью улучшения оттока лимфы
УДД 5 УУР С [10]
3.3.7.4. КМБ: вовлеченность пациента
Целесообразно информировать пациента о принципах компрессионного бандажирования как до, так и после процедуры, о необходимости физических упражнений и об уходе за перевязанной конечностью. Необходимо информировать пациента, на какое время наложен компрессионный бандаж в его случае. Следует дать рекомендации по распознаванию потенциальных проблем, таких как признаки ишемии, включая, появление боли, нарушение чувствительности, появление парестезий и измененных ощущений, изменения температуры или цвета видимых участков кожи. Желательно предоставить информацию о том, к кому можно обратиться в случае возникновения проблемы. Вовлеченность пациента в терапию, его комплаентность к назначенной компрессионной терапии во многом определяют ее успех [289].
3.3.7.5. Компрессионный трикотаж
- Рекомендуется применение компрессионного трикотажа в лечении первичной или вторичной лимфедемы в составе КФПТ, в качестве самостоятельного метода лечения как дополнение к хирургическим методам лечения с целью поддержания результатов лечения, профилактики прогрессирования лимфедемы или рецидива лимфатического отека
УДД 5 УУР С [10,66,67,98]
Комментарий 1. Возможность, целесообразность и безопасность применения компрессионного трикотажа как самостоятельного метода лечения определяет специалист, проводящий лечение пациента с лимфедемой, исходя из особенностей клинического случая.
Комментарий 2. Цели применения компрессионного трикотажа соответствуют целям применения компрессионной терапии в целом, однако основными целями являются профилактика прогрессирования лимфатического отека и, в меньшей степени, уменьшение лимфатического отека. В уменьшении отека компрессионный трикотаж имеет ограниченные возможности и может применяться с этой целью только на ранних стадиях лимфедемы при минимальной выраженности отека. В случаях выраженного отека не рекомендуется подбирать и использовать компрессионный трикотаж до завершения активной фазы КФПТ. По данным систематического обзора 2016 г. регулярное использование компрессионного трикотажа при вторичной лимфедеме не уменьшает отек, но предотвращает его прогрессирование [336]. Регулярное использование компрессионного трикотажа замедляет или останавливает прогрессирование лимфедемы. В РКИ установлена меньшая доля прогрессирования РМЖ-ассоциированной лимфедемы в группе применения компрессионного рукава в сравнении с группой без применения компрессии на сроке 6 мес наблюдения: 16% и 57% соответственно, p = 0,001 [323].
Комментарий 3. Типы вязки компрессионного трикотажа. При выборе типа компрессионного трикотажа (плоской или круговой вязки), вида изделий, а также степени компрессии требуется учитывать множество факторов, включая стадию лимфедемы, конфигурацию конечности, наличие или отсутствие осложнений лимфедемы, наличие или отсутствие хронических заболеваний, а также индивидуальные особенности каждого конкретного пациента. К сожалению, оценка всех этих особенностей не поддается стандартизации и проводится эмпирически. В целом выбор типа вязки компрессионного трикотажа (круговая или плоская) зависит от клинико-функционального диагноза. Большинство врачей и ученых, долгое время занимающихся лечением лимфедемы, рекомендуют использовать в лечении лимфедемы именно трикотаж плоской вязки (особенно, начиная с лимфедемы 2-й стадии). Следует отметить, что компрессионный трикотаж плоской вязки относят к компрессионным изделиям короткой растяжимости, которые обеспечивают высокое давление при движениях и низкое давление покоя, что оптимально в лечении лимфедемы, особенно ее тяжелых стадий. Компрессионный трикотаж круговой вязки относят к изделиям средней растяжимости, которые не столь эффективны в создании высокого давления при движениях, и при этом создают довольно значительное давление покоя. Компрессионный трикотаж круглой вязки можно использовать для компрессионной терапии пациентов с хроническими заболеваниями вен, профилактики лимфедемы или при лечении лимфедемы 1 стадии с отеком малой выраженности. При установлении клинико-функционального диагноза лимфедема нижних конечностей 2,3,4 стадии следует использовать лечебный компрессионный трикотаж плоской вязки, при необходимости изготовленный по индивидуальным размерам больного.
Комментарий 4. Выбор степени компрессии компрессионного трикотажа. Компрессионные изделия различаются у разных производителей и могут быть изготовлены на заказ (по индивидуальным меркам) или подобраны по стандартным размерным сеткам. Наиболее высокие классы компрессии — это, как правило, компрессионный трикотаж плоской вязки. Выбор степени компрессии имеет первостепенное значение. В отечественных рекомендациях по ХЗВ на протяжении многих лет ориентиром для выбора компрессионных изделий служил принятый в Германии стандарт RAL 387, поэтому специалистам хорошо известна градация степеней компрессии по этому стандарту. Однако это не означает, что качественный компрессионный трикотаж обязательно соответствует стандарту RAL. Напротив, большая часть производимого в мире трикотажа сертифицируется по другим национальным или трансграничным стандартам. В разных стандартах используется различная градация классов (степеней) компрессии. Поэтому в практической работе необходимо указывать не класс (степень) компрессии, а требуемый диапазон давления, оказываемого компрессионным изделием на уровне лодыжки, либо соотносить класс компрессии с используемым стандартом.
Для верхних конечностей при лимфедеме чаще всего выбирают компрессионный трикотаж с давлением 22-32 мм.рт.ст., при плохо контролируемых лимфатических отеках класс компрессии для верхних конечностей можно увеличить до 34-46 мм.рт.ст. Для нижних конечностей при лимфедеме обычно используется трикотаж с давлением 34-46 мм.рт.ст. или выше 49 мм.рт.ст.
Комментарий 5. Особенности компрессии дистальных отделов конечностей. Для верхних конечностей оптимально использовать компрессию, начиная с пальцев на кисти, заканчивая подмышечной областью (наиболее характерные изделия для верхних конечностей – это рукава и перчатки с пальцами). Для нижних конечностей наиболее распространенными типами компрессионного трикотажа являются гольфы, чулки, колготы, перчатки на стопы и другие различные модификации этих изделий. Использование компрессионных изделий без компрессии па пальцах кисти или стопы чревато появлением или увеличением отека пальцев. При лечении пациентов с лимфедемой конечностей целесообразно применение компрессионных перчаток для кистей и стоп, либо бандажирование кистей, стоп и пальцев больных конечностей вне зависимости от наличия отека этих областей [337].
- В течение первых 12 мес применения компрессионного трикотажа рекомендуется периодическая оценка его эффективности для окончательного подбора оптимального типа изделия, режима его применения, степени компрессии, частоты смены изделия.
УДД 5 УУР С [10,66,67,98,324]
Комментарий. Периодичность оценки эффективности применения компрессионного трикотажа и корректировку терапии определяет специалист, занимающийся лечением пациента с лимфедемой. Эффективность применения компрессионного трикотажа оценивается по отсутствию отека или сохранению наименьшей выраженности отека, достигнутой при проведении активной компрессионной терапии. Помимо подбора оптимального компрессионного изделия специалист определяет необходимость изготовления компрессионного трикотажа по индивидуальным меркам и достаточность применения одиночного изделия на конечность. В некоторых ситуациях вместо увеличения степени компрессии одиночного изделия целесообразно рекомендовать пациенту надевать несколько компрессионных изделий невысокой степени компрессии друг на друга. Такой подход обеспечивает большее давление на конечность, нежели сумма давлений надеваемых изделий, за счет трения сцепления между изделиями. При этом последовательное надевание изделий малой степени компрессии значительно легче для пациента, чем надевание трикотажа высокой степени компрессии [338,339].
- При неэффективности компрессионного трикотажа круговой вязки или невозможности/неэффективности применения компрессионного трикотажа плоской вязки стандартного пошива у пациентов с лимфедемой конечностей рекомендуется применение компрессионного трикотажа плоской вязки, изготовленного по индивидуальным меркам.
УДД 5 УУР С [10,66,67,98,324]
Комментарий 1. В лечении лимфедемы 0-1 стадии можно использовать компрессионный трикотаж как круговой, так и плоской вязки. Изделия круговой вязки, как правило, более растяжимы, чем изделия плоской вязки. Однако такой трикотаж может быть достаточен при лимфедеме малой или умеренной выраженности и является компрессионным изделием «первой линии».
Комментарий 2. Рекомендуется снятие мерок для индивидуального пошива компрессионного трикотажа специалистами, специально обученными производителем компрессионного трикотажа. Вместе с тем следует отметить, что даже при должном обучении и снятии мерок обученным специалистом, невозможно во всех случаях обеспечить оптимальное соответствие изготовленного изделия конечности пациента. Целесообразно наблюдение лечащим врачом и принятие решения о необходимости дальнейшей коррекции трикотажа.
3.3.7.6. РКС: регулируемые компрессионные системы
Регулируемые компрессионные системы (РКС, adjustable compression wrap devices) представляют из себя изделия, состоящие из множества циркулярных компрессионных лент, объединенных в одну систему. Необходимый профиль давления в РКС обеспечивается натягиванием или ослаблением отдельных лент. РКС относятся к неэластичным или малорастяжимым компрессионным изделиям. В настоящее время применяется несколько РКС (CircAid, Juxta-Fit, ReadyWrap, FarrowWrap, Coolflex, Juzo wrap 6000 и др.). С момента появления РКС в начале 2000-х, эти системы изучены в ряде исследований, однако большинство из них носит наблюдательный характер или дизайн описания серии случаев [340,341]. Благодаря особенностям надевания и настройки уровня компрессии, в ряде случаев РКС облегчают пациентам самостоятельное проведение компрессионной терапии, уход за кожей и повышают их приверженность назначенному врачом режиму компрессионной терапии во второй фазе КФПТ [342–344].
- Рекомендуется рассмотреть применение регулируемой компрессионной системы в лечении пациентов с первичной и вторичной лимфедемой конечностей в качестве метода компрессионной терапии в составе комплексной физической противоотечной терапии
УДД 2 УУР B [288,327,345]
Комментарий. РКС могут применяться в качестве верхнего слоя КМБ. Существуют ограниченные данные о возможности применения РКС в качестве полной замены КМБ. По результатам нескольких РКИ эффективность РКС может быть сопоставима с эффективностью КМБ [288,327,345]. Возможность, целесообразность и безопасность применения РКС в качестве замены КМБ определяет специалист, проводящий лечение пациента с лимфедемой, исходя из особенностей клинического случая.
- Рекомендуется рассмотреть применение регулируемой компрессионной системы в лечении пациентов с первичной и вторичной лимфедемой конечностей в качестве основного метода лечения при невозможности проведения комплексной физической противоотечной терапии
УДД 4 УУР С [346]
Комментарий. В отсутствие возможности проведения комплексной физикальной противоотечной терапии, как показано в описании серии случаев, РКС могут эффективно применяться в качестве основного средства лечения [346].
Общие правила применения РКС:
- Возможность и целесообразность применения РКС при лечении пациента с лимфедемой, модель, режим ношения, уровень давления и прочие детали определяются специалистом, проводящим лечение пациента с лимфедемой, с учетом особенностей конкретной клинической ситуации;
- При использовании РКС необходимо создавать компрессию на пальцы (бинтом или трикотажем), т.к. РКС сами по себе не оказывают воздействие на эти области и без создания давления в них могут послужить причиной перемещения отека дистально;
- При использовании РКС (как и при многослойном бандажировании) необходимо применять дополнительные подкладочные материалы для защиты кожи;
- Недопустимо применять изолированно сегмент РКС на проксимальную часть конечности, не создав компрессию дистальнее.
3.3.7.7. Компрессионная терапия: противопоказания
Противопоказания к проведению компрессионной терапии при лимфедеме не имеют специфичности и соответствуют таковым при других нозологиях. Актуальный анализ противопоказаний к применению эластической компрессии представлен в международном консенсусном документе 2020 года [337].
Противопоказания к применению компрессионной терапии:
- Тяжелые формы ХОЗАНК (лодыжечно-плечевой индекс (ЛПИ) < 0,6; систолическое давление на лодыжке < 60 мм.рт.ст.; систолическое давление на пальцах < 30 мм.рт.ст.; чрескожное напряжение кислорода (tcpO2) < 20 мм.рт.ст.);
- Критическая ишемия конечности;
- Сердечная недостаточность IV функционального класса (NYHA IV);
- Сердечная недостаточность III функционального класса (NYHA III) при невозможности мониторинга основных параметров гемодинамики;
- Подтверждённая аллергия на материал;
- Тяжелые формы периферической нейропатии и диабетической микроангиопатии.
Тяжелая сердечная недостаточность (IV функциональный класс, NYHA IV – выраженные симптомы сердечной недостаточности, активность резко ограничена, стенокардия и симптомы СН появляются в покое, при любой активности усиливаются) является абсолютным противопоказанием к проведению компрессионной терапии. Проведение компрессионной терапии у пациентов с ХСН III функционального класса (умеренно выраженные симптомы ХСН, активность резко снижена, при незначительной нагрузке – активность менее обычной – появляются усталость, сердцебиение, одышка) допустимо только при мониторинге мониторинга клинических и гемодинамических показателей [347]. Градация применимости компрессионной терапии у пациентов с ХОЗАНК в зависимости от уровня ЛПИ (лодыжечно-плечевого индекса давления) по Международному консенсусному документу «Lymphoedema Framework. Best Practice for the Management of Lymphoedema. International consensus» представлена на Рисунке 2 [78].
Рисунок 2. Градация применимости компрессионной терапии у пациентов с ХОЗАНК в зависимости от уровня ЛПИ.
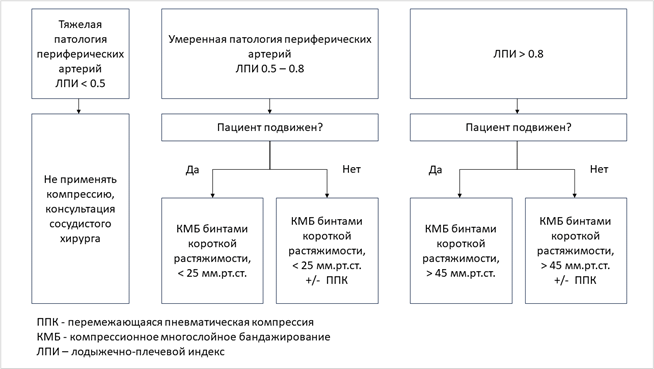
3.3.8. КФПТ: ЛФК, физические упражнения
3.3.8.1. ЛФК, общие положения
Физическая активность, упражнения, лечебная физкультура традиционно рассматриваются как неотъемлемый компонент КФПТ [72,98,139]. Далее по тексту для удобства этот компонент лечения лимфедемы будет обозначаться термином ЛФК (лечебная физкультура). Цели ЛФК:
- Уменьшение симптомов лимфедемы;
- Увеличение диапазона движений пораженной конечности;
- Увеличение силы пораженной конечности;
- Улучшение общих функциональных показателей пациента;
- Улучшение контроля массы тела;
- Улучшение ментального и эмоционального состояния пациента;
- Улучшение качества жизни пациента в целом.
При рассмотрении эффективности и безопасности ЛФК следует выделить ее применение у двух категорий пациентов:
- Эффективность и безопасность ЛФК у пациентов с лимфедемой без хирургического вмешательства в зоне лимфатических путей конечности;
- Эффективность и безопасность ЛФК у пациентов, перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ).
Большинство исследований и систематических обзоров по применению ЛФК при лимфедеме относится к пациентам после оперативного лечения РМЖ.
3.3.8.2. ЛФК у пациентов с лимфедемой без хирургического вмешательства в зоне лимфатических путей конечности
- ЛФК рекомендуется как компонент КФПТ у пациентов с лимфедемой без хирургического вмешательства в зоне лимфатических путей конечности с целью уменьшения симптомов лимфедемы, улучшения функции конечности, контроля веса тела, поддержания хорошей физической формы и улучшения качества жизни
УДД 5 УУР С [98]
Комментарий. В рекомендациях Международного общества лимфологов 2020 года указывается, что, несмотря на отсутствие доказательств эффективности ЛФК в уменьшении проявлений лимфедемы, исследования последовательно подтверждают, что ЛФК безопасна и позволяет уменьшить симптомы лимфедемы, улучшить функцию конечности, способствует контролю веса, поддержанию хорошей физической формы пациента и улучшает его качество жизни. В систематическом обзоре 2018 г., включающем 11 РКИ по лечению РМЖ-ассоциированной лимфедемы (458 женщин с лимфедемой), была изучена эффективность различных физических упражнений, включая аэробные упражнения, упражнения с отягощениями, йогу, плавание, аква-фитнес, упражнения с гравитационно-силовыми нагрузками [348]. В четырех из РКИ, вошедших в указанный обзор, было обнаружено значительное уменьшение объема рук, а в семи исследованиях сообщалось о значительных субъективных улучшениях.
3.3.8.3. ЛФК у пациентов с лимфедемой, перенесших хирургическое вмешательство в зоне лимфатических путей конечности
- ЛФК рекомендуется как компонент КФПТ у пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) с целью профилактики развития лимфедемы, уменьшения симптомов и проявлений лимфедемы, увеличения мышечной силы, увеличения минеральную плотность костной ткани, улучшения функции конечности и объема движений, контроля веса тела, поддержания хорошей физической формы и улучшения качества жизни
УДД 2 УУР B [349,350]
Комментарий 1. В исследованиях и систематических обзорах по применению ЛФК после оперативного лечения РМЖ рассматривается несколько вопросов: эффективность ЛФК в профилактике развития вторичной лимфедемы, риск провоцирования развития лимфедемы при проведении ЛФК, эффективность ЛФК при сформировавшей вторичной лимфедеме. В 2023 году опубликован систематический обзор, суммирующий современные научные данные по применению ЛФК у пациентов с РМЖ-ассоциированной лимфедемой (зонтичный систематический обзор) [349]. Данный обзор, проведенный по правилам PRISMA, охватил 7 клинических рекомендаций, 4 консенсусных документа и 11 систематических обзоров. Качество проанализированных клинических рекомендаций и консенсусных документов по критериям AGREE II оценено как умеренное и высокое. Качество систематических обзоров по критериям AMSTAR оценено от критически низкого до высокого. Резюме рекомендаций (в первоисточнике резюме сопровождается детализацией доказательной базы) представлено в Приложении А 3.4. «Рекомендации по ЛФК для пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности».
Комментарий 2. В Кохрановском систематическом обзоре 2023 г. по применению ЛФК у пациентов с РМЖ, получающих только лучевую терапию, указаны возможные положительные эффекты ЛФК (уменьшение утомляемости, повышение работоспособности, переносимости нагрузок, улучшение качества жизни), однако отмечается малая величина клинического эффекта и низкое качество доказательств [351].
- ЛФК рекомендуется как безопасное средство у пациентов, перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) и получающих противоопухолевую терапию
УДД 3 УУР B [352,353]
- Рекомендуется использовать компрессионный трикотаж во время ЛФК у пациентов с лимфедемой конечности с целью профилактики прогрессирования лимфедемы
УДД 3 УУР С [78,354,355]
Комментарий. Некоторые исследования показывают, что выполнение физических упражнений у пациентов с лимфедемой может быть безопасно (не провоцирует прогрессирование лимфедемы) без какой-либо компрессии [356]. Однако это справедливо только в отношении определенных групп пациентов, а качество доказательств безопасности проведения ЛФК без компрессии низкое. Основой рекомендации использовать компрессионный трикотаж во время выполнения физических упражнений пациентам с лимфедемой является представление, что компрессия безопасна для всех пациентов с лимфедемой и такое применение компрессии не наносит вреда, напротив, физические упражнения без компрессии несут риск усиления симптомов и проявлений лимфедемы у некоторых пациентов. В международном консенсусном документе рекомендуется выполнять физические упражнения в компрессионном трикотаже [78].
Данная позиция подкреплена результатами нескольких РКИ [354,355]:
- Рекомендуется рассмотреть целесообразность использования компрессионного трикотажа во время ЛФК у пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) при отсутствии лимфедемы с целью профилактики ее развития
УДД 2 УУР B [349]
3.3.8.4. Отдельные виды физической активности
Пациентам с лимфедемой или из группы риска ее развития целесообразно избегать травмоопасных видов спорта и упражнений с повышенным риском повреждения кожных покровов. Это правило обусловлено высоким риском развития инфекции при повреждении кожи и риском появления/усиления отека в ответ на травматическое повреждение мягких тканей и костей конечности. При выборе физической активности предпочтение следует отдавать ее видам с наименьшей травматической опасностью.
Пациентам с лимфедемой целесообразно тренироваться не менее 3-5 раз в неделю в течение не менее 20-30 минут в день. Преимущества физических упражнений должны быть объяснены пациенту, и регулярные упражнения должны быть начаты как можно скорее. Существуют различные виды упражнений, которые полезны и должны сочетаться в тренировках. Сочетание аэробных упражнений, упражнений на растяжку и упражнений с сопротивлением имеет важное значение для всех пациентов с лимфедемой, одно не заменяет другое, что может иметь значение для составления индивидуальной программы ЛФК. Целесообразно начинать с аэробных динамических упражнений сразу после постановки диагноза и постепенно увеличивать нагрузку, в том числе во время противоотечной фазы КФПТ и поддерживающей фазы КФПТ [348,357–360]. Приведенные выше исследования демонстрируют, что упражнения с постепенным увеличением силы сопротивления не повышают риск развития лимфедемы или ее прогрессирования до тех пор, пока пациент находится под наблюдением специалиста и выполняет его рекомендации. По мнению членов рабочей группы, широкий спектр различных упражнений и видов физической активности, представленный в этих исследованиях и обзоре Baumann F.T., применим как у пациентов, перенесших хирургическое вмешательство в зоне лимфатических путей конечности, так и у пациентов с лимфедемой, не ассоциированной с РМЖ.
Упражнения с отягощением/сопротивлением могут выполняться с помощью резиновых спортивных лент, эспандеров, небольших гантелей или собственного веса тела. Их следует выполнять 2-3 раза в неделю и начинать с низкой нагрузки. Рекомендуется согласовать уровень нагрузки и набор упражнений со специалистом по физической реабилитации или лечению лимфедемы. При выполнении упражнений следует избегать длительных статических нагрузок, либо во время выполнения статического упражнения делать короткие перерывы с динамическими упражнениями или расслабляющими движениями. Не рекомендуется начинать с тяжелых / интенсивных упражнений, если пациент не делал никаких упражнений раньше; это включает в себя подъем тяжестей или упражнения с выраженным сопротивлением. Для перехода к упражнениям с большими весами и выраженным сопротивлением (например, тяжелая атлетика) необходима предварительная консультация с врачом ЛФК и спортивной медицины с целью определения толерантности к физическим нагрузкам, целевой ЧСС, выявления противопоказаний и ограничений. Начинать такие тренировки необходимо под контролем специалиста по физической реабилитации с упражнений умеренной интенсивности. Увеличение частоты и интенсивности тренировок должны всегда обговариваться с медицинским специалистом [78]. Многие пациенты жалуются на потерю чувствительности в пальцах кисти и скованность суставов при лимфедеме верхней конечности в рамках постмастэктомического синдрома. Поэтому рекомендуется включать упражнения на мелкую моторику и упражнения на проприоцептивную чувствительность в рамках лечения лимфедемы верхней конечности. Эти упражнения, в свою очередь, также способствуют усилению работы мышечного насоса в области кисти, что улучшает транспорт лимфы и способствует ликвидации отека [361]. Целесообразно включать упражнения для тазового дна как для мужчин, так и для женщин при лимфедеме гениталий и/или нижних конечностей [362].
Скандинавская ходьба. Скандинавская ходьба обеспечивает вовлечение в работу практически всех групп мышц тела и является одной из наиболее рекомендуемых форм аэробных упражнений для пациентов с лимфедемой. По данным систематического обзора 2020 г. скандинавская ходьба у пациентов, перенесших хирургическое вмешательство по поводу РМЖ, оказывает значительное положительное влияние на симптомы и проявления лимфедемы, снижает риск инвалидизации пациента, улучшает общую физическую форму и восприятие болезни [363]. Подобные положительные эффекты скандинавской ходьбы продемонстрированы в систематическом обзоре ее применения у пациентов с избыточным весом и ожирением [364]. Таким образом, скандинавская ходьба может быть рекомендована пациентам с лимфедемой конечностей, в том числе при избыточном весе и ожирении, как эффективный метод повышения общей физической активности и улучшения качества жизни.
Упражнения в воде. Систематическое обзорное исследование литературы (scoping review) 2023 г. (включено 9 исследований, в т.ч. 8 РКИ) показало, что упражнения в воде, по-видимому, уменьшают боль и улучшают качество жизни у пациентов с лимфедемой верхних или нижних конечностей [365]. Напротив, в контрольных группах качество жизни показало тенденцию к ухудшению с течением времени. В некоторых включенных в обзор исследованиях показано увеличение мышечной силы и уменьшение объема больной конечности. В то же время авторы подчеркивают многочисленные ограничения анализируемых исследований, связанных с гетерогенностью исследуемых популяций и протоколов физической активности. Роль водных упражнений в консервативном лечении лимфедемы требует дальнейшего изучения, однако они могут быть рекомендованы пациентам с лимфедемой конечностей как метод повышения общей физической активности и улучшения качества жизни.
Как указано в разделе «Консервативная профилактика развития вторичной лимфедемы», длительное нахождение в среде с повышенной температурой может являться фактором риска развития лимфедемы у пациентов группы риска или прогрессирования лимфедемы. Оптимальной является температура не выше 28°C [366]. По некоторым данным, при длительном воздействии воды температурой 34°C отек может усиливаться [367].
Повреждения кожи или кожные заболевания являются противопоказанием к проведению ЛФК в общем бассейне.
Танцы. В Кохрановском систематическом обзоре 2015 года авторы указывают на некоторые положительные эффекты танцев при реабилитации пациентов после лечения РМЖ, однако ограниченность и гетерогенность данных не позволила авторам сделать общие выводы о влиянии танцев на психологические и физические исходы у онкологических больных [368]. Вместе с тем, в более поздних исследованиях накапливаются дополнительные данные о пользе физической активности в виде танцев [369]. Танцы могут быть рекомендованы пациентам группы риска развития лимфедемы конечностей в качестве альтернативы ЛФК как метод повышения общей физической активности и улучшения качества жизни. Использование танцев в качестве метода физической активности у пациентов с лимфедемой конечностей не изучено и может применяться в качестве альтернативы ЛФК на усмотрение и под контролем специалиста, занимающего лечением пациента с лимфедемой, с учетом особенностей клинического случая.
Дыхательная гимнастика. Целесообразно включать глубокие дыхательные упражнения, включая диафрагмальное и грудное дыхание, в план лечения пациентов с лимфедемой. Глубокие дыхательные упражнения обладают успокаивающим эффектом, имеют положительный эффект на общее самочувствие, способствуют улучшению оксигенации, показаны с самых ранних этапов реабилитации. Положительный эффект диафрагмального и глубокого дыхания непосредственно на лимфатическую систему связан с дренажным эффектом в области млечной цистерны и облегчением венозного и лимфатического возврата [370].
3.3.9. КФПТ: уход за кожей. Лечение трофических дефектов кожи и ПЖК
3.3.9.1. Ежедневный уход за кожей
- Рекомендуется ежедневный уход за кожей пораженной конечности пациента с лимфедемой с целью профилактики и лечения кожных осложнений лимфедемы.
УДД 5 УУР С [72,98,139,149,371]
Комментарий. На сегодняшний день нет РКИ по отдельным процедурам и средствам ухода за кожей при лимфедеме. Вместе с тем уход за кожей целью профилактики и лечения кожных осложнений лимфедемы в рекомендациях профессиональных сообществ выделен в качестве важного, обязательного компонента КФПТ. В некоторых рекомендациях предлагаются протоколы ухода за кожей, составленные на основании обзоров литературы и мнения экспертов.
- При ежедневном уходе за кожей конечности с лимфедемой рекомендуется следовать Протоколу ежедневного ухода за кожей конечности с лимфедемой (см. Приложение А3.3)
УДД 5 УУР С [72,372]
Комментарий 1. Протокол ежедневного ухода за кожей (см. Приложение А3.3) разработан на основании протокола All-Ireland Lymphoedema Guidelines 2022 г., в котором использованы материалы 2 тематических обзоров литературы, а также дополнений от Hobday A [72,105,372,373].
Комментарий 2. Для очистки кожи использовать теплую воду. Рекомендуется вместо мыла использовать его заменители на водной или масляной основе (например, Aqueous cream). Такие заменители не обладают подсушивающим и раздражающим эффектами. При использовании мыла следует использовать pH-нейтральное мыло, которое нужно хорошо смывать.
Комментарий 3. При выборе средства для увлажнения кожи следует учитывать основу средства для кожи. Преимущественно сухую кожу лучше увлажнять кремами с высоким содержанием жира. Хотя лосьоны для кожи обладают приятным охлаждающим эффектом и быстро впитываются кожей, в долгосрочной перспективе они высушивают кожу. Масляные кремовые основы можно использовать в прохладные дни, когда с кожи испаряется меньше пота. Днем можно использовать быстро впитывающиеся кремы для рук, а ночью - более насыщенные кремы [105,374–376]
3.3.9.2. Кожные осложнения лимфедемы
К наиболее частым кожным осложнениям лимфедемы относятся:
- Папилломатоз;
- Подошвенный дерматит;
- Атопическая экзема;
- Гиперкератоз;
- Мацерация кожных складок;
- Лимфорея;
- Фолликулит;
- Грибковые инфекции; онихомикоз.
При развитии дерматита следует устранить потенциальные раздражители. При отсутствии положительного эффекта следует направить пациента на консультацию к врачу-дерматовенерологу для рассмотрения целесообразности назначения местных лечебных средств. К лечению кожных нарушений целесообразно привлекать врача-дерматовенеролога.
3.3.9.3. Папилломатоз: местное лечение
Лимфостатический папилломатоз кожи — тяжелое осложнение хронической лимфедемы, характеризующееся бородавчатыми папилломатозными разрастаниями. Папилломатоз развивается на фоне фиброза и гиперкератоза кожи [371,377].
- При папилломатозе конечности с лимфедемой рекомендуется лазерная абляция или хирургическое удаление (иссечение) папиллом с целью замедления его прогрессирования.
УДД 5 УУР С [68,371,378]
Комментарий. Активное лечение поражений кожи обязательно для замедления прогрессирования заболевания. Папилломатозные кожные разрастания являются субстратом для бактериальной и грибковой колонизации. Для рассмотрения возможности и назначения медикаментозной терапии необходимо направление пациента с папилломатозом на консультацию к врачу-дерматовенерологу. На ранних стадиях папилломатоз может обратим при проведении активной КФПТ. Одним из основных способов устранения папилломатозных разрастаний является их лазерная абляция. В тяжелых случаях целесообразно хирургическое иссечение для замедления прогрессирования заболевания. Хирургическое иссечение или лазерная абляция должны проводиться вплоть до сосочкового слоя кожи [371].
3.3.9.4. Лимфорея
Лимфа является химически активной щелочной жидкостью, быстро вызывает мацерацию кожи и может привести к формированию обширных эрозий. Появление лимфореи требует корректировки терапии ввиду опасности развития инфекционных осложнений и вторичного повреждения кожи.
- При развитии лимфореи рекомендуется как можно раньше начать активную компрессионную терапию с применением компрессионного многослойного бандажирования для прекращения лимфореи и профилактики мацерации кожи
УДД 5 УУР С [72]
Комментарий. Лимфорея является распространенным осложнением лимфедемы. Несмотря на нехватку клинических исследований высокого качества, профессиональными сообществами сформулированы рекомендации по лечению лимфореи на основании мнения экспертов. Основным способом борьбы с лимфореей признается активная компрессионная терапия с помощью компрессионного многослойного бандажирования. Особенности терапии лимфореи:
− Начать (скорректировать) бандажирование конечности как можно раньше при развитии лимфореи;
− После очистки кожи больной конечности и перед наложением бандажа необходимо нанести барьерный крем вокруг зоны лимфореи для защиты кожи от мацерации;
− В первом слое бандажа применять абсорбирующие материалы; при выраженной лимфорее необходимо использовать «суперпоглотители»;
− При значительном истечении лимфы может потребоваться смена бандажа чаще чем раз в сутки.
Перспективным способом лечения лимфореи является вакуумное лечение (negative pressure wound therapy, NPWT) [379,380].
3.3.9.5. Трофические дефекты (эрозии, язвы)
Трофическая язва — дефект кожи и мягких тканей, не заживший в течение 6 недель. При наличии или появлении язвенного дефекта у пациента с лимфедемой конечности необходимо исключить сопутствующую артериальную и венозную патологию как возможную причину язвообразования [381].
Принципы лечения трофических язв при лимфедеме конечностей соответствуют принципам лечения венозных трофических язв [382].
- Основой лечения является устранение отека;
- Хирургический дебридмент рекомендуется как предпочтительный метод местного лечения на первоначальном этапе очищения трофической язвы (хирургический дебридмент - удаление некротизированных тканей и фибринового налета с помощью скальпеля, кюретки, ножниц, ложечки Фолькмана или лазера);
- Целесообразно использовать современные раневые покрытия, адаптированные к стадии раневого процесса, создающие сбалансированную влажную среду, оптимальную для регенераторных процессов. Выбор конкретных лечебных средств зависит от особенностей раневого процесса, состояния тканей, окружающих трофическую язву. Выбор перевязочного средства требует обязательного учета фазы течения раневого процесса и степени экссудации. При выраженной экссудации из трофической язвы или эрозии необходимо использовать «суперпоглотители».
Виды перевязочных средств представлены в Приложении А 3.5. «Виды перевязочных средств для лечения язвы у пациентов с лимфедемой конечности».
3.3.10. Контроль массы тела
- Пациенткам с вторичной лимфедемой, связанной с раком молочной железы, при отсутствии активности рака и отсутствии необходимости проведения противоопухолевой терапии, рекомендуется снижение веса с помощью индивидуальных рекомендаций по питанию с целью повышения эффективности уменьшения лимфатического отека при компрессионной терапии
УДД 2 УУР B [383]
Комментарий. В РКИ продемонстрировано, что снижение суточного потребления калорий до 1000 – 1200 ккал (4184-5020 кДж) за счет сокращения в рационе доли рафинированных углеводов и жиров, привело к более эффективному уменьшению лимфатического отека на фоне терапии с помощью компрессионного трикотажа. Критериями включения в исследование были: ремиссия рака, отсутствие необходимости проведения химиотерапии или лучевой терапии [383].
3.3.11. Дополнительные методы консервативного лечения лимфедемы
3.3.11.1. ППК: перемежающаяся пневматическая компрессия (аппаратная пневмокомпрессия)
Перемежающаяся пневматическая компрессия (ППК, аппаратная пневмокомпрессия, intermittent pneumatic compression) - один из методов, применяемых в лечении отеков, в т.ч. лимфатических. Метод реализуется за счет того, что отечная конечность помещается в устройство по типу «рукава», «свитера», «чулка» или «штанов», имеющее одну или несколько секций (камер), в которые электрическим насосом нагнетается воздух до заданного уровня давления. Заполнение камер воздухом и сдувание камер циклично, может иметь различную очередность. Например, если заполнение камер происходит от дистальных к проксимальным, создается эффект, похожий на перистальтический, направленный вдоль оси конечности в каудальную сторону.
Для ППК действительны ограничения и противопоказания, описанные для компрессионной терапии («Компрессионная терапия: противопоказания»). Противопоказанием к применению ППК является наличие метастазов в области применения, отек туловища и/или основания конечности.
- Рекомендуется рассмотреть целесообразность применения ППК при лечении лимфедемы конечности с целью уменьшения проявлений лимфедемы в качестве дополнения к КФПТ
УДД 1 УУР B [384–386]
Комментарий 1. Данные по эффективности ППК в лечении лимфедемы конечностей противоречивы. Ряд РКИ не показал пользу ее применения [387–390]. Вместе с тем, все систематические обзоры применения ППК в лечении лимфедемы нижних и верхних конечностей после 2010 г. демонстрируют пользу применения ППК в отношении уменьшения объема конечности при лимфедеме [384–386]. Комментарий 2. Возможно использование ППК у обездвиженных пациентов с отеками для уменьшения их выраженности. При этом следует быть особенно осторожным в выборе уровня создаваемого давления в связи с распространенностью у таких пациентов нарушений чувствительности и хрупкости кожных покровов.
- Рекомендуется рассмотреть возможность использования для проведения ППК устройств современного дизайна, закрывающих не только отечную конечность, но и прилегающую часть корпуса, гениталии и противоположную конечность, с целью снижения риска развития осложнений ППК в виде проксимального отека конечности, отека туловища и формирования фиброзного кольца подкожной клетчатки в основании конечности.
УУД 2 УУР В
Комментарий. Некоторые данные свидетельствуют о преимуществе современных систем для ППК, покрывающих не только больную конечность, но и прилегающую часть туловища, область гениталий и часть противоположной конечности [391,392]. В зарубежной литературе такие системы именуются advanced pneumatic compression devices, APCDs (продвинутые/расширенные системы для пневматической компрессии). Пневмокомпрессионные системы, закрывающие области гениталий и/ или корпуса, снижают риск перемещения отека в эти области и образование фиброзных колец.
- Рекомендуется рассмотреть целесообразность применения ППК в дополнение к основным компонентам КФПТ при проведении пациентом с лимфедемой конечности самостоятельной терапии в период поддерживающей фазы КФПТ
УДД 2 УУР B [385]
Комментарий. В рамках поддерживающей фазы КФПТ ППК может применяться по назначению и под контролем специалиста по лечению лимфедемы в качестве дополнения к другим компонентам КФПТ, осуществляемым пациентом самостоятельно. Кроме того, ППК может использоваться в качестве метода компрессионной терапии во время ожидания изготовленного на заказ компрессионного трикотажа. Эффективность самостоятельного применения ППК на дому показана в нескольких исследованиях [391,393].
- Не рекомендуется как предпочтительный какой-либо режим проведения ППК по уровню давления, очередности наполнения компрессионных камер и продолжительности лечебного сеанса
УДД 3 УУР B [78,394]
Комментарий. В международном согласительном руководстве по лечению лимфедемы отмечается, что консенсус относительно оптимального давления ППК при лечении лимфедемы отсутствует [78]. Требуется тщательное наблюдение за пациентом, чтобы убедиться в правильности применяемой техники и давления. Давление следует подбирать с учетом переносимости пациентом. В целом предлагается следующий режим проведения ППК:
− Основной лечебный интервал давления от 30 до 60 мм.рт.ст.;
− При оказании паллиативной помощи рекомендуется использовать интервал давления 20-30 мм.рт.ст.;
− Рекомендуется ежедневное проведение сеансов ППК продолжительностью от 30 минут до 2 часов.
В указанном руководстве дополнительно отмечается, что ППК может усугубить или вызвать формирование отека или «фиброзного кольца» в основании конечности, не вовлеченной в компрессионную процедуру, если лимфатические сосуды в основании конечности не были опорожнены. ППК нижних конечностей может вызвать отек гениталий. ППК не рекомендуется проводить при наличии отека у основания конечности или в прилегающей области. ППК должна назначаться практикующими врачами, прошедшими соответствующую подготовку на уровне специалистов. В систематическом обзоре РКИ от 2019 г. отмечается прослеживаемая на протяжении 20 лет тенденция к уменьшению применяемого при ППК давления и сокращению времени процедур [384]. Это способствует распространению аппаратов ППК в качестве устройств вспомогательной компрессионной терапии для самостоятельного (домашнего) применения. В выводах данного систематического обзора отмечается, что доказательства умеренного качества подтверждают эффективность ППК в уменьшении лимфатического отека при проведении сеансов с последовательным заполнением камер длительностью 45-60 минут с давлением от 30 до 60 мм.рт.ст. В исследовании Pilch U. по изучению эффективности ППК с разной продолжительностью циклов и разным числом компрессионных камер у пациенток РМЖ-ассоциированной лимфедемой достоверное уменьшение объема конечности наблюдалось во всех терапевтических подгруппах, независимо от продолжительности цикла и количества камер [394].
- Не рекомендуется использовать ППК как единственный/самостоятельный метод лечения лимфедемы.
УДД 5 УУР С [78]
Комментарий. В приведенных выше в обоснование эффективности ППК систематическом обзоре и рандомизированных исследованиях отмечалась эффективность ПКК только при сочетании с КФПТ как в 1 фазе лечения, так и на стадии удержания результатов. Т.е. этот метод является дополняющим КФПТ, и перед процедурой ППК необходимо выполнить мануальный лимфодренажный массаж, а после ППК необходима компрессионная терапия в виде бандажирования или компрессионного трикотажа, без чего эффект от ППК может быстро исчезнуть.
Осложнения ППК. При использовании ППК необходимо учитывать, что возможен ряд осложнений. Наиболее часто отмечались [78,395,396].
- отек гениталий (в случае применения при отеке нижней конечности);
- усиление отека основания конечности и части корпуса, прилегающей к отечной конечности и образование «фиброзного кольца» в основании конечности;
- ускорение фиброзных процессов в ПЖК.
Несмотря на наличие данных о развитии тех или иных осложнений при применении ППК (частота вышеперечисленных осложнений в некоторых публикациях составляет 10-43%), во многих исследованиях отрицательные эффекты ППК не упоминаются. Это обусловлено значительным разнообразием методик применения ППК (разные когорты пациентов, различия в дизайне, количестве камер, уровне давления при процедуре, длительности воздействия, сочетания с другими элементами КФПТ и т.п.). На момент написания КР невозможно дать определенные рекомендации по величине давления и по продолжительности воздействия с точки зрения безопасности и снижения рисков развития побочных эффектов. С учетом риска развития осложнений и того, что в подавляющем большинстве случаев с помощью КФПТ без добавления ППК можно добиться необходимых клинических результатов, к назначению ППК, в том числе для самостоятельного применения на дому, следует относиться крайне взвешенно и осторожно. Риск осложнений в области основания конечности и туловища возрастает при использовании ППК, если предварительно не выполнен мануальный лимфодренаж соответствующих квадрантов и областей. Для снижения риска развития осложнений важно подготовить пациента к процедуре ППК. Проработка корпуса при помощи мануального лимфодренажа очень важна для улучшения лимфотока через альтернативные неповрежденные пути оттока и для снижения лимфатического объёма и давления в лимфатических сосудах в области корпуса.
3.3.11.2. Кинезиотейпирование
Тейпирование представляет из себя фиксацию к коже в зоне поражения узких полос эластичной малорастяжимой ленты. Изначально тейпирование применялось в спортивной медицине и ортопедии для создания определенных эффектов на опорно-двигательный аппарат, однако в последующем было предположено, что тейпирование может прямо или опосредованно положительно влиять на поверхностную лимфатическую систему и ток лимфы. Кинезиотейпирование в лечении пациентов с лимфедемой имеет крайне ограниченную доказательную базу и не всегда упоминается как возможная лечебная опция в рекомендациях профессиональных сообществ. Применение тейпирования для лечения лимфедемы не рассматривается в международном консенсусном документе по диагностике и лечению лимфедемы 2022 г. и отсутствует в рекомендациях AVF 2017 г [66,67]. В рекомендациях Международного общества лимфологов 2020 г. отмечается наличие исследований по применению кинезиотейпирования у пациентов с РМЖ-ассоциированной лимфедемой с положительными эффектами [98]. Несмотря на крайне ограниченные данные об эффективности кинезиотейпирования в определенных клинических ситуациях, этот метод получил достаточно широкое распространения в практике [397].
- Рекомендуется рассмотреть целесообразность применения кинезиотейпирования при лечении РМЖ-ассоциированной лимфедемы верхней конечности с целью уменьшения проявлений лимфедемы в качестве дополнения или компонента КФПТ
УДД 1 УУР С [398]
Комментарий. Эффективность кинезиотейпирования в уменьшении объема конечности при РМЖ-ассоциированной лимфедеме доказана в систематическом обзоре с метаанализом данных РКИ от 2023 г [398]. В указанный систематический обзор из предварительно отобранных 123 исследований в соответствии с критериями включения вошло только 7 РКИ. Авторы отмечают, что получены доказательства положительного влияния кинезиотейпирования на объем конечности, однако расценивают качество доказательств как низкое. В отдельных исследованиях описываются различные положительные клинические эффекты кинезиотейпирования: уменьшение объема конечности, уменьшение боли и других субъективных симптомов, улучшение функции конечности. В РКИ от 2023 года авторы сравнили эффективность кинезиотейпирования, МЛД и облучение кожи низкоэнергетическим лазером перед обязательным бандажированием конечности и выполнением физических упражнений у пациенток с РМЖ-ассоциированной лимфедемой. Процедуры проводились 5 дней в неделю в течение 3 недель, контроль осуществлен по завершении лечения, через 4 и 12 недель после лечения. В группе кинезиотейпирования зафиксирован наибольший регресс отека конечности (различия с группой МЛД статистически достоверны, p = 0,009, p = 0,039 и p = 0,042 соответственно контрольным визитам) [399]. Схожие результаты получены у пациенток с РМЖ-ассоциированной лимфедемой в РКИ со сравнением кинезиотейпирования и применения компрессионного рукава. При кинезиотейпировании отмечен больший регресс отека (-5,7%, SD = 2,0 против -3,4%, SD = 2,9, p<0,001) [400]. Целесообразно рассмотреть применение кинезиотейпирования в областях, где отек сложно поддается компрессионной терапии – молочная железа, лицо, область лобка.
- Кинезиотейпирование не рекомендуется как самостоятельный метод лечения лимфедемы конечностей.
УДД 2 УУР С [401]
Комментарий. На момент проведения систематического обзора литературы от 2014 г. не было получено доказательств эффективности применения кинезиотейпирования как метода лечения лимфедемы конечностей [401]. До настоящего времени не появились РКИ или систематические обзоры по оценке эффективности кинезиотейпирования при первичной лимфедеме конечностей. Единственное РКИ, возможно относящееся к пациентам с первичной лимфедемой (этиология лимфедемы включенных в исследование пациентов не указана), имеет существенные методологические ограничения (отсутствие расчета объема выборки, малая выборка – по 15 исследуемых в группе, отсутствие сравнительного анализа по клиническому исходу – выраженности отека) и не позволяет сделать вывод об эффективности кинезиотейпирования у этой категории пациентов [402].
3.3.11.3. Физиотерапия
- Не рекомендуется применение физиотерапевтических процедур пациентам с лимфедемой нижних конечностей ввиду отсутствия методов с доказанной эффективностью.
УДД 5 УУР С [67,68,72,98,139,144]
Комментарий. Нет доказательств эффективности физиотерапевтического лечения пациентов с лимфедемой нижних конечностей. Методы физиотерапии не предлагаются в качестве компонентов лечения в руководствах и рекомендациях по лечению профессиональных сообществ.
3.3.11.4. Магнитотерапия
При анализе публикаций не найдено доказательств эффективности магнитотерапии в лечении пациентов с лимфедемой конечности.
3.3.11.5. НИЛТ: низкоинтенсивная лазерная терапия
НИЛТ (низкоинтенсивная лазерная терапия (НИЛТ, low-level laser therapy, LLLT), известная также как фотобиомодуляционная терапия (ФБМТ, photobiomodulation therapy, PBMT)) - это неинвазивная терапия, в которой используются длины волн красного или ближнего инфракрасного света от 650 до 1000 нм для доставки излучения низкой интенсивности к ткани-мишени. В последние 20 лет предпринимаются попытки применения НИЛТ в поддерживающей терапии пациентов с раком молочной железы или РМЖ-ассоциированной лимфедемой. Вместе с тем, результаты систематических обзоров, изучающих влияние НИЛТ на исходы лимфедемы, противоречивы.
В 2022 году опубликован критический обзор систематических обзоров (зонтичный систематический обзор) по эффективности и безопасности НИЛТ в лечении пациентов с РМЖ-ассоциированной лимфедемой, который суммирует накопленные к сегодняшнему дню научные данные по данному вопросу [403]. Второй частью опубликованной работы был новый систематический обзор РКИ по применению НИЛТ. Заключение авторов: выводы различных систематических обзоров об эффективности НИЛТ по клиническим исходам (уменьшение окружности конечности, уменьшение объема конечности, «твердость» тканей, субъективные симптомы, сила захвата и качество жизни) неоднородны и противоречивы, однозначный вывод невозможен. По всей видимости, включение НИЛТ в комплексную терапию лимфедемы не повышает эффективность лечения в целом. Решение о целесообразности применения НИЛТ в лечении пациента с лимфедемой конечности принимает врач, курирующий пациента, с учетом особенностей клинического случая и предпочтений пациента.
3.3.12. Фармакотерапия в лечении лимфедемы конечностей
- Не рекомендуется фармакотерапия (в том числе лимфотропная) в лечении лимфедемы конечностей ввиду отсутствия средств с доказанной эффективностью
УДД 2 УУР А [404–407]
Комментарий. В систематических обзорах последних лет не установлены препараты, эффективные в лечении лимфедемы [404–406,408]. В систематическом обзоре Forte AJ. с соавт. 2919 г. некоторые из включенных исследований были экспериментальными, некоторые клинические исследования изучали суррогатные исходы [407]. Препараты, вошедшие в этот обзор (циклофосфамид, селенит натрия/селен, кетопрофен, пегсанерцепт (растворимый ингибитор фактора некроза опухолей), такролимус), по всей видимости, влияют на процессы воспаления, сопровождающие лимфедему, не улучшают клинические результаты ее лечения. Эффективность бензопиронов оценена в Кохрановском систематическом обзоре 2004 г [408]. Рассмотрено применение оксерутина, препаратов «Цикло-3-форт» (торговое название), «Дафлон» (торговое название), кумаринов. Анализ данных не позволил сделать вывод в пользу эффективности рассматриваемых препаратов в лечении лимфедемы. С момента выхода указанного обзора новых исследований высокого качества в поддержку применения препаратов группы бензопиронов не опубликовано. Кумарины (подгруппа бензопиронов) могут проявлять гепатотоксичность [98].
В клинических руководствах и рекомендациях профессиональных сообществ фармакотерапия лимфедемы не рекомендуется [72,98,139].
- Не рекомендуется применение диуретиков для лечения лимфедемы конечностей. Диуретики могут применяться у пациентов с лимфедемой конечности по показаниям, связанным с сопутствующей патологией
УДД 5 УУР С [98]
Комментарий. Некоторые свидетельства эффективности диуретической терапии при лечении лимфедемы были получены на небольших группах пациентов в 1950-х и 1960-х годах у пациентов с первичным лимфедемой [409]. В последние десятилетия не проводилось никаких исследований, изучающих эффективность диуретиков при лечении первичной или вторичной лимфедемы. В рекомендациях Международного общества лимфологов 2020 предлагается ограничить применение диуретиков их назначением отдельным пациентам с сопутствующими заболеваниями, требующими применения диуретической терапии, а также рекомендуется избегать длительного приема диуретиков из-за риска развития нарушение электролитного баланса [98].
- Пациентам после лечения РМЖ, требующим гипотензивной терапии, рекомендуется избегать назначения блокаторов кальциевых каналов в связи с повышенным риском развития лимфедемы конечности
УДД 3 УУР B [410]
Комментарий. В исследовании случай-контроль 2019 г. установлена ассоциация между приемом блокаторов кальциевых каналов и развитием лимфедемы у пациентов после лечения РМЖ [410]. Скорректированное отношение шансов составило ОШ = 1,3 (95% ДИ 1,0-1,7). Однако, хотя эти результаты предполагают корреляцию между использованием блокаторов кальциевых каналов и развитием лимфедемы, они не устанавливают причинно-следственную связь. В рекомендациях All-Ireland Lymphoedema Guidelines 2022 г. отмечается, что этих данных недостаточно для определения противопоказаний к применению блокаторов кальциевых каналов, однако после лечения РМЖ следует, по возможности, использовать другие гипотензивные средства [72].
3.3.13. Перспективные методы лечения лимфедемы
В настоящее время активно изучаются различные методы и стратегии лечения лимфедемы направленные на регенерацию или создание лимфатической системы с использованием стволовых клеток, лимфангиогенных факторов, тканевой биоинженерии и др. Данные методы и стратегии не имеют доказательной базы в клинической практике, не могут применяться в лечении пациентов с лимфедемой вне рамок клинических исследований и являются отражением научного поиска перспективных способов лечения лимфедемы [411–413].
3.4. Хирургическое лечение лимфедемы
3.4.1. Цели, показания и общие условия проведения хирургического лечения
3.4.1.1. Цели хирургического лечения:
- Уменьшение объема конечности;
- Улучшение/восстановление функции конечности;
- Снижение риска инфекционных осложнений лимфедемы;
- Улучшение внешнего вида и устранение деформации конечности;
- Уменьшение боли, ассоциированной с лимфедемой;
- Профилактика осложнений локализованных первичных лимфатических поражений;
- Устранение лимфореи;
- Уменьшение проявлений лимфедемы (интегральная цель, включающая уменьшение объема, улучшение/восстановление функции конечности, уменьшение боли, ассоциированной с лимфедемой).
3.4.1.2. Показания к хирургическому лечению
- Необходимость устранить нежидкостный компонент лимфедемы;
- Необходимость снизить зависимость пациента от компрессионного трикотажа для контроля над отеком;
- Рецидивирующая рожа, не поддающаяся медикаментозным способам профилактики;
- Нарушение функции конечности;
- Деформация и обезображивание конечности;
- Боль, ассоциированная с лимфедемой;
- Локализованные первичные поражения (лимфоцисты, ограниченные лимфатические мальформации);
- Лимфорея.
Данное положение не относится к вмешательствам по устранению локализованных первичных лимфатических поражений.
3.4.1.3. Общие условия проведения хирургического лечения
Успех хирургического лечения лимфедемы в первую очередь зависит от опыта хирурга, отбора пациентов, проведения предоперационной подготовки и послеоперационных мероприятий.
- Не рекомендуется выполнение хирургических вмешательств на конечности с лимфедемой без предварительного проведения активной КФПТ для устранения или максимального уменьшения отека конечности.
УДД 5 УУР С [78,98,414–416]
Комментарий. Вне зависимости от вида операции необходимо выполнение следующих условий:
− До проведения хирургического вмешательства необходимо проведение КФПТ за 3-6 месяцев для устранения или максимального уменьшения отека конечности с переходом на поддерживающую компрессионную терапию с контролем ее эффективности;
− Обязательное послеоперационное ведение, в т.ч. ношение компрессионного трикотажа (особенности описаны в соответствующих подразделах хирургического лечения);
− Достаточная инструментальная диагностика с целью определить целесообразность, локацию и безопасность того или иного вида хирургического лечения
3.4.2. Типы хирургических вмешательств при лимфедеме.
Хирургические вмешательства при лимфедемы делят на 2 типа:
Редукционные. Направлены, в первую очередь, на уменьшение объема конечности.
Реконструктивные. Направлены на восстановление или улучшение лимфатического оттока.
3.4.3. Редукционные операции при лимфедеме конечностей.
Редукционные операции проводятся для уменьшения объема конечности и являются паллиативными (кроме операций по поводу локализованных форм лимфатических мальформаций). Основные цели применения редукционных операций:
- уменьшение объема и деформации конечности;
- уменьшение боли, ассоциированной с лимфедемой;
- улучшение функции конечности.
К редукционным операциям при лимфедеме конечности относят прямое иссечение (липодерматофасцэктомия) и липосакцию [415].
3.4.3.1. Липодерматофасцэктомия
- Рекомендуется рассмотреть целесообразность выполнения липодерматофасцэктомии у пациента с тяжелым объемным поражением конечности (лимфедема 3 стадии со значительным снижением или утратой функции конечности) или в локализациях, где неприменима липосакция, с целью уменьшения объема и восстановления функции конечности.
УДД 5 УУР С [78]
Комментарий. Для лечения лимфедемы конечностей описано множество процедур прямого иссечения мягких тканей пораженной конечности [417–419]. Вместе с тем, с развитием липосакции методы прямого иссечения мягких тканей стали применяться реже и используются при крайне тяжелых объемных поражениях конечности, а также в локализациях, где липосакция неприменима (например, мошонка). Лимфедематозные ткани иссекаются единым блоком, включая кожу, подкожную клетчатку и поверхностную фасцию. Образовавшиеся дефекты закрываются либо тканевыми лоскутами, либо кожными трансплантатами.
3.4.3.2. Липосакция
- Рекомендуется рассмотреть целесообразность выполнения липосакции у пациента с лимфедемой конечности 2-3 стадии с целью уменьшения проявлений лимфедемы (включая уменьшение объема, улучшение/восстановление функции конечности, уменьшение боли, ассоциированной с лимфедемой)
УДД 5 УУР С [78,420]
Комментарий. Липосакция весьма эффективна в лечении лимфедемы конечностей, благодаря этому хирургическому вмешательству можно удалить лишний объем тканей, сформировавшийся за счет процессов фиброза и избыточного роста жировой ткани. Эта процедура относительно проста в выполнении и при соблюдении предоперационной подготовки с обязательным устранением отека при помощи активной фазы КФПТ и послеоперационных мероприятий имеет низкий уровень осложнений, таких как незначительные инфекции и парестезии. После липосакции может наблюдаться значительное (>90%) и долгосрочное уменьшение объема конечностей и улучшение качества жизни при условии проведения пожизненной поддерживающей компрессионной терапии [415]. В систематическом обзоре липосакции при лимфедеме нижних конечностей продемонстрировано существенное уменьшение объема, улучшение функции конечности, улучшение качества жизни и снижение риска развития инфекционных осложнений лимфедемы [421]. Авторы рекомендуют применение липосакции при лимфедеме 2-3 стадии с последующей поддерживающей компрессионной терапией. В систематическом обзоре применения липосакции при лимфедеме верхних конечностей достигнуто полное устранение избыточного объема конечности при неэффективности предшествующей консервативной терапии по устранению разницы в объеме (консервативная терапия устраняет жидкостный, но не тканевой компонент лимфедемы) [422]. В разделе «Хирургическое лечение первичной и вторичной лимфедемы» обновляемого руководства UpToDate на основании анализа ряда публикаций предлагаются следующие показания к выполнению липосакции на верхней конечности [420]:
− Неэффективность в устранении разницы в объёме конечностей при проведении КФПТ более 3 месяцев;
− Разница в объеме конечности не менее 600 куб.см.;
− Симптомы лимфедемы, включая тяжесть, боль, напряжение в плечах и/или;
− Нарушение функции конечности;
− Рецидивирующие инфекции.
Противопоказания к липосакции [414,423,424]:
- Лимфангиосаркома;
- Повреждения кожи (раны, язвы, мацерация и т.п.);
- Новообразования и метастазы в области операции;
- Нарушения свертываемости крови и прием антикоагулянтов;
По мнению Brorson H. не следует применять липосакцию для лечения лимфедемы у пациентов с ИМТ >30-32, в случае отказа от пожизненного ношения компрессионного трикотажа, а также при разнице в объеме менее 600 см3 для верхних конечностей.
Особенности предоперационной подготовки, проведения липосакции и послеоперационного ведения пациента подробно представлены в Приложении А 3.6. «Липосакция: особенности подготовки, проведения и послеоперационного ведения».
3.4.4. Реконструктивные операции при лимфедеме конечностей.
3.4.4.1. Реконструктивные операции: общие положения
К реконструктивным микрохирургическим операциям для лечения лимфедемы конечностей относят лимфо-венозное шунтирование (наложение лимфо-венозных или лимфо-венулярных анастомозов (ЛВА), лимфо-нодуловенозных анастомозов) и трансплантацию васкуляризованных лимфоузлов (ТВЛ).
Лимфовенозные и лимфовенулярные анастомозы в настоящее время используются во многих центрах по всему миру. Долгосрочное сохранение функции анастомозов получило подтверждение в длительных периодах наблюдения (в некоторых случаях более 25 лет), эффективность подтверждается объективными параметрами [98]. В выводах систематического обзора от 2020 г. указано, что наложение лимфо-венозных анастомозов обеспечивает уменьшение объема конечностей и уменьшение субъективных проявлений лимфедемы у большинства пациентов, а сохранение функции анастомозов при долгосрочном наблюдении свидетельствует о высокой надежности метода [425]. В систематическом обзоре применения микрохирургических операций (наложение лимфовенозных анастомозов и пересадка васкуляризованных лимфатических узлов) от 2023 г. указаны 3 наиболее частых положительных исхода хирургического лечения: уменьшение окружности конечности, уменьшение объема конечности, уменьшение числа инфекционных эпизодов в год. При этом в исследовании не указано, как влияла на уменьшение размеров КФПТ и в каком виде и объеме она проводилась [426]. Среднее уменьшение окружности конечности составило -35,6% (95% ДИ: от -30,8 до -40,3), уменьшение объема -32,7% (95% ДИ: от -19,8 до -45,6), уменьшение числа эпизодов инфекции в год -1,9 (95% ДИ: от -1,4 до -2,3).
Данные по эффективности микрохирургических операций, включающих лимфо-венозные анастомозы и пересадку васкуляризованных лимфатических узлов, длительное время оставались противоречивыми. Наряду с исследованиями, показывающими положительные результаты, ряд исследований демонстрировали отсутствие эффекта от указанных операций [427,428]:
Кроме того, в ранних систематических обзорах указанных исследований не удавалось объединить данные [429]. Результаты систематических обзоров с метаанализом данных последних лет согласованно демонстрируют пользу выполнения ЛВА и ТВЛ в ряде клинических ситуаций [430]. После микрохирургии 63% пациентов не нуждались в активной фазе КФПТ, а у 96% не наблюдались рецидивы кожных инфекций. Только 12% пациентов сообщили, что отек конечности вновь появился в долгосрочной перспективе. Вместе с тем, 26% пациентов потребовалась повторная операция из-за неудовлетворительного результата первой, у 32% пациентов отмечалась лимфорея.
В нескольких систематических обзорах исследований установлено значительное улучшение качества жизни после ЛВА и ТВЛ независимо от этиологии лимфедемы, стадии или времени с момента постановки диагноза [431,432]. В профессиональном сообществе имеются значительные разногласия относительно подходящего периода ожидания, прежде чем следует рассмотреть целесообразность выполнения реконструктивной операции. Наилучшие результаты получены при проведении реконструктивных операций на ранних стадиях лимфедемы [433]. При этом задержка операции более чем на один год существенно увеличивает риск неудачи операции из-за хронического повреждения лимфатической системы [68].
В некоторых специализированных центрах применяется наложение лимфовенозных анастомозов в качестве профилактической меры у пациентов с высоким риском развития лимфедемы. Вместе с тем, в консенсусном международном документе по диагностике и лечению лимфедемы получены следующие результаты опроса экспертов по вопросу «Хирургия в качестве приемлемой стратегии для профилактики развития лимфедемы у пациентов высокого риска или для лечения лимфедемы на ранней стадии (0-I стадии)» [66]:
- Категорически не согласны: 36%
- Не согласны: 21%
- Частично не согласны: 19%
- Частично согласны: 9%
- Согласны: 9%
- Категорически согласны 6%
На сегодняшний день нет данных, достаточных для подтверждения целесообразности и эффективности отсроченного наложения ЛВА в профилактических целях.
Реконструктивные операции на лимфатической системе у предварительно обследованных пациентов проводят как дополнение к КФПТ после удаления жидкостного компонента лимфедемы. Лечение пациента с лимфедемой не должно начинаться с выполнения реконструктивной операции. В успехе реконструктивной операции существенное значение имеет отбор пациентов. С особой осторожностью следует относиться к оценке возможности выполнения реконструкции лимфатической системы у детей с первичной лимфедемой в связи с частыми значительными изменениями пот типу гипоплазии и аплазии.
Поле выполнения реконструктивной операции на лимфатической системе необходимо проведение консервативной терапии (КФПТ и/или компрессионной терапии) с целями и по показаниям, определенным в разделе «Консервативное лечение лимфедемы». Если микрохирургические реконструктивные операции не применяются достаточно рано в качестве профилактического подхода (например, у пациентов с 0 стадией лимфедемы), консервативная терапия необходима для достижения и поддержания стойкого клинического результата, так как исходная длительная лимфатическая гипертензия приводит к значительным и необратимым изменениям лимфатических сосудов.
- Рекомендуется рассмотреть целесообразность выполнения реконструктивной операции на лимфатической системе у пациента с лимфедемой конечности с целью предотвращения прогрессирования или уменьшения проявлений лимфедемы при:
- прогрессировании лимфедемы несмотря на проведение КФПТ (при обязательном условии выполнения КФПТ опытными специалистами и выполнения пациентом всех рекомендаций специалиста в фазе поддержания результата);
- недостаточной эффективности КФПТ по устранению отека и удержанию стабильного результата лечения в анатомических областях, тяжело поддающихся компрессионной терапии, при обязательном условии выполнения КФПТ опытными специалистами и выполнения пациентом всех рекомендаций специалиста в фазе поддержания результата;
- необходимости уменьшить количество времени, проводимого пациентом в компрессионном трикотаже;
- хилезном рефлюксе в сочетании с лимфедемой конечности;
- множественных рецидивах местной или системной инфекции, ассоциированной с лимфедемой .
УДД 5 УУР С [66,324]
- Реконструктивные операции с целью уменьшения проявлений лимфедемы рекомендуется выполнять на ранних стадиях лимфедемы (I стадия, ранняя II стадия)
УДД 2 УУР B [98,139,245,429,433,434]
Комментарий. Реконструктивные операции наиболее эффективны до развития необратимых изменений в мягких тканях и лимфатических сосудах конечности.
- Не рекомендуется выполнение реконструктивных операций при лимфедеме III стадии
УДД 4 УУР С [68,435]
- При планировании реконструктивной операции по поводу лимфедемы конечности рекомендуется рассмотрение целесообразности проведения дополнительных методов визуализации лимфатической системы
УДД 5 УУР С [66–68,98,139,162,324]
Комментарий. Необходимость проведения и вид дополнительных методов инструментального исследования определяет хирург, планирующий и выполняющий реконструктивную операцию на лимфатической системе. Для визуализации субфасциальных и надфасциальных лимфатических путей целесообразно выполнение лимфосцинтиграфии (A07.06.003, лимфосцинтиграфия). Лимфосцинтиграфия является «золотым стандартом» визуализации лимфатической системы при планировании реконструктивных операций, так как обеспечивает функциональную оценку лимфатических путей. Для идентификации функционирующих подкожных лимфатических сосудов и узлов, подходящих для использования в реконструкции, целесообразно проведение флуоресцентной лимфографии (ICG-лимфографии). ICG-лимфография демонстрирует только подкожные лимфатические сосуды, что имеет решающее значение для правильной оценки возможностей реконструкции в случае обструкции крупных лимфатических сосудов и коллекторов. Так как проникающая способность визуализации этого метода не более 2 см, рекомендуется до его выполнения максимально уменьшить или устранить отек. Для поиска функционирующих лимфатических сосудов в дополнение к ICG-лимфографии можно использовать МР-лимфографию и ультразвуковое исследование на сканере с высоким разрешением [324,436].
Особенности предоперационной подготовки и послеоперационного ведения пациента при выполнении реконструктивных операций на лимфатической системе подробно представлены в Приложении А 3.7. «Реконструктивные операции: особенности подготовки и послеоперационного ведения».
3.4.4.2. ЛВА: лимфовенозные и лимфовенулярные анастомозы
Лимфовенозные и лимфовенулярные анастомозы (ЛВА) – варианты микрохирургической реконструктивной операции на лимфатической системе, направленные на улучшения оттока лимфы за счет дренирования лимфатической жидкости в венозную систему. Принципиальной разницы в технике, показаниях и противопоказаниях между этими двумя процедурами нет. Разница заключается лишь в разнице диаметров сшиваемых сосудов (при лимфовенозных анастомозах сшиваются сосуды диаметром более 0,5 мм, при лимфовенулярных – от 0,2 мм до 0,5 мм).
- Рекомендуется рассмотреть в качестве варианта реконструктивной операции в хирургическом лечении лимфедемы конечности наложение лимфовенозных/ лимфовенулярных анастомозов.
УДД 2 УУР В [433]
Комментарий. Систематический обзор применения лимфовенозных анастомозов в лечении лимфедемы нижних конечностей от 2022 г. включил результаты лечения 2554 нижних конечностей. Средний возраст пациентов варьировал от 22,6 до 76,14 лет. Продолжительность лимфедемы до проведения операции варьировала от 12 месяцев до 11,4 лет. Объективные показатели улучшения лимфедемы варьировали от 23,3% до 100%, при этом наибольшая степень улучшения наблюдалась у пациентов с ранней стадией лимфедемы [433]. Систематический обзор применения лимфовенозных анастомозов в лечении лимфедемы верхних конечностей от 2021 г. включил результаты лечения 244 верхних конечностей. Средний возраст пациентов варьировал от 38,4 до 64 лет. Продолжительность лимфедемы до проведения операции варьировала от 9 месяцев до 7 лет. Средняя продолжительность наблюдения варьировала от 6 месяцев до 8 лет. В четырнадцати исследованиях (из 16 включенных в обзор) сообщалось об объективном улучшении течения лимфедемы: уменьшение окружности или объема конечностей в диапазоне от 0% до 100%. Пациенты имели различную степень тяжести лимфедемы (от 0 до III стадии). Максимальное улучшение объективных показателей зафиксировано у пациентов с лимфедемой меньшей стадии [437]. В обоих указанных обзорах авторы расценивают операции с наложением лимфо-венозных анастомозов эффективным и безопасным способом лечения пациентов с лимфедемой конечности.
- Не рекомендуется выполнение операции а наложением лимфовенозных и лимфовенулярных анастомозов при наличии у пациента сопутствующей хронической венозной недостаточности на оперируемой конечности
УДД 5 УУР С [67]
- Рекомендуется, при возможности, создавать множественные лимфовенозные/ лимфовенулярные анастомозы
УДД 4 УУР С [98]
Комментарий. Хотя нет единого мнения о количестве анастомозов, необходимых для достижения значительного уменьшения лимфатического отека, считается, что увеличение количества лимфовенозных анастомозов может улучшить лимфоотток. Множественные анастомозы на одном хирургическом участке как с поверхностными, так и с глубокими лимфатическими сосудами, по всей видимости, позволяют создать положительный градиент лимфовенозного давления и избежать появления гравитационного рефлюкса не прерывая дистальные периферические поверхностные лимфатические пути.
3.4.4.3. ЛНВА: лимфонодуловенозные анастомозы
Данные по эффективности наложения анастомозов между лимфатическими узлами и венами (лимфонодуловенозные анастомозы, ЛНВА) ограничены. В ретроспективности исследовании 2021 года сравнили применение у пациентов с лимфедемой II и III стадии только лимфовенозных анастомозов (ЛВА) и комбинацию из наложения лимфовенозных и лимфонодуловенозных анастомозов (ЛВА + ЛНВА) [438]. В группе ЛНВА отмечено значительно более быстрое уменьшение окружности конечности и объема внеклеточной жидкости в ней. Корреляционный анализ показал, что положительный результат ассоциирован с использованием лимфатического узла с размером не менее 8 мм на предоперационной МР-лимфографии.
В качестве технических особенностей операции в данном исследовании указаны:
- Визуальная оценка функции узла. Истечение прозрачной лимфатической жидкости после рассечения капсулы лимфатического узла является показателем “функционирования” лимфатического узла. Перед наложением анастомоза необходимо дождаться появления прозрачной жидкости без примеси крови, так как появление примесей крови может увеличить вероятность тромбоза анастомоза.
- Микрохирургическая техника анастомоза: прокол капсулы узла, расширение прокола капсулы, подшивание проксимального конца рядом расположенной вены к капсуле «нейлоном»10/0. Данный метод позволяет уменьшить травматизацию афферентных и эфферентных лимфатических сосудов и увеличить объем собираемой лимфы. Ранее часто анастомоз формировали между поперечно разрезанным паховым лимфатическим узлом и стенкой вены с использованием «нейлона» 6/0 или 7/0. В настоящее время такую практику целесообразно пересмотреть.
- Для анастомоза лучше использовать вместо большой подкожной вены вену меньшего калибра с отсутствием обратного тока крови.
3.4.4.4. ТВЛ: трансплантация васкуляризованных лимфоузлов
Эффективность пересадки васкуляризованных лимфоузлов подтверждается как в отдельных исследованиях, так и в систематических обзорах с метаанализом данных по микрохирургии лимфедемы. Результаты систематических обзоров приведены в разделе «Реконструктивные операции: общие положения».
В РКИ 2016 г. при ТВЛ достигнуто уменьшение объема конечности в среднем на 57%, снижение частоты рецидива инфекции и улучшение функции конечности [439].
- Не рекомендуется трансплантация васкуляризованных лимфоузлов у пациентов с первичной лимфедемой конечности
УДД 5 УУР С [67,98,324,440]
Комментарий. У пациентов с первичной лимфедемой нередко наблюдается глобальная лимфатическая дисфункция, о чем свидетельствует ICG лимфография. Это исключает любую процедуру пересадки лоскута у таких пациентов из-за повышенного риска ятрогенной лимфедемы донорского участка, оставляя лимфовенозные (лимфовенулярные) анастомозы в качестве более безопасной альтернативы).
При выполнении ТВЛ следует принять во внимание следующие особенности [324,440–444]:
- Следует рассмотреть целесообразность ТВЛ на ранней стадии лимфедемы при наличии в тканях жидкостного компонента;
- Лоскут, используемый для трансплантации, может иссекаться из различных анатомических областей (пахово-абдоминальный, торако-дорзальный, субментальный, супраклавикулярный, большой сальник и пр.). У каждого доступа есть свои преимущества, недостатки и ограничения, выбор осуществляется в индивидуальном порядке лечащим хирургом;
- Предлагается пересаживать лоскут на дистальную часть конечности в область лодыжки или запястья при дистальных отеках и в подмышечную/паховую область при проксимальных отеках. Следует отметить, что при дистальной трансплантации в область запястья/лодыжки контур конечности в этом месте будет значительно изменен за счет формы лоскута;
- Чтобы процедура пересадки лимфатического лоскута была эффективной, лоскут помещают ближе к лимфатическому отеку и в непосредственной близости от относительно меньшего числа дегенеративных лимфатические сосудов. Оба критерия удовлетворяются в дистальной части конечности (лодыжка/запястье);
- Предлагается ориентировать лоскут таким образом, чтобы ось его лимфатических сосудов соответствовала оси лимфатических сосудов участка реципиента, чтобы обеспечить спонтанные лимфо-лимфатические связи;
- При сочетании липосакции и пересадки лимфатических лоскутов предлагается выполнять липосакцию на проксимальных участках, а пересадку лимфатических узлов на дистальных участках;
- При выполнении липосакции и пересадки лимфатических лоскутов в одной анатомической зоне предлагается выполнить процедуры с интервалом в 6 месяцев;
- Предлагается при пересадке лимфатических лоскутов использовать обратное лимфатическое картирование. Пересадка лимфатических лоскутов сопровождается риском развития лимфедемы донорского участка в результате забора лимфатических узлов, особенно когда забор производится из паховой или аксиллярной области. Обратное лимфатическое картирование может помочь снизить этот риск путем выявления лимфатических узлов, дренирующих конечность.
3.4.5. Комбинированные вмешательства при лимфедеме конечности
В систематическом обзоре 2019 г. показаны преимущества комбинации пересадки лимфоузлов и липосакции при РМЖ-ассоциированной лимфедеме [445]. Результаты этого систематического обзора предполагают, что комбинация пересадки лимфатических узлов и липоаспирации является методом, который может улучшить результаты, достижимые только одной из этих операций у пациентов с РМЖ-ассоциированной лимфедемой 2–3 стадии.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
4.1. Медицинская реабилитация при лимфедеме конечности: общие сведения
Лимфедема верхних и нижних конечностей снижает качество жизни и трудоспособность пациентов, что продемонстрировано в ряде систематических обзоров [446,447]. Хирургическое и консервативное лечение лимфедемы (КФПТ) улучшает качество жизни и функцию конечности, однако не всегда удается достигнуть максимально возможного эффекта лечения и сохранить его результат в течение длительного времени [447,448]. Поэтому в процессе наблюдения и лечения пациента с лимфедемой конечности целесообразно использовать методы реабилитации. Целью применения методов реабилитации является компенсация утраченных/нарушенных функций конечности и повышение качества жизни пациентов. Хотя вторичная лимфедема часто связана с онкологической патологией, в данной работе не рассматриваются методы и программы реабилитации пациентов с раком. Реабилитация пациентов с лимфедемой может включать элементы физической и психической реабилитации.
Подробно применимость, эффективность и безопасность различных вариантов физической активности и лечебной физкультуры рассмотрены в разделе «Лечение, включая медикаментозную и немедикаментозную терапию» / «Консервативное лечение лимфедемы» / «КФПТ: ЛФК, физические упражнения». Профилактика развития вторичной рак-ассоциированной лимфедемы рассмотрена в разделе «Профилактика развития вторичной лимфедемы» / «Консервативная профилактика развития вторичной лимфедемы».
Целесообразно рассмотрение санаторно-курортного лечения для реабилитации пациентов с лимфедемой конечности. При выборе санаторно-курортного лечения следует ориентироваться на возможность проведения лечебной физкультуры, методик ходьбы (терренкур), упражнений в воде (бассейне). Подробно упражнения в воде и ходьба как методы ЛФК описаны в пунктах «Упражнения в воде» и «Скандинавская ходьба» раздела «Консервативное лечение лимфедемы» / «КФПТ: ЛФК, физические упражнения» / «Отдельные виды физической активности».
4.2. Психологическая коррекция
- Рекомендуется рассмотреть целесообразность применения психологической коррекции у пациентов с лимфедемой конечности с целью уменьшения проявлений тревоги и депрессии, астенического синдрома.
УДД 3 УУР B [449]
Комментарий. Лимфедема иногда сопровождается высокой степенью тревоги и депрессии, существенным нарушением психосоциального благополучия [450,451]. В сравнительном исследовании применение методов психологической коррекции позволило достоверно снизить показатели тревоги и депрессии в 2 раза [449]. Специалист, занимающийся лечением лимфедемы, может рекомендовать пациенту с лимфедемой консультацию психолога или врача-психотерапевта
4.3. Бальнеотерапия, гидротерапия, акватерапия у пациентов с лимфедемой конечности.
В систематическом обзоре Reger M, 2022 проанализированы результаты 12 исследований с участием 430 пациентов с рак-ассоциированной лимфедемой (преимущественно РМЖ). Программы терапии включали гидротерапию, водные упражнения, ванны для ног и ванны для всего тела. Оцениваемыми исходами были выраженность отека, качество жизни, утомляемость, ИМТ, тревога и боль. Исследования имели среднее качество и сообщали о гетерогенных результатах. В некоторых исследованиях сообщалось о значительном улучшении качества жизни, выраженности лимфедемы, боли в шее и плечах, утомляемости и ИМТ, в то время как в других исследованиях не было обнаружено каких-либо изменений в отношении этих конечных точек. Из-за очень разнородных результатов и методических ограничений включенных исследований невозможно сделать однозначное заключение об эффективности водной терапии при лимфедеме у онкологических больных [452]. Неоднородные результаты, не позволяющие сделать вывод были получены и в более раннем систематическим обзоре Yeung W., 2018 г [453].
Эффективность акватерапии у пациентов с лимфедемой нижних конечностей продемонстрирована в небольшом РКИ 2017 г. со сравнением занятий в бассейне под руководством инструктора и самомассажа [454]. Оцениваемые исходы: объем стопы (волюметрия вытеснением воды), функция ходьбы (тест 6-минутной ходьбы), качество жизни (опросник SF-36), психологическое состояние (специализированные шкалы). По всем показателям получена достоверно более выраженная положительная динамика в группе занятий в бассейне. Авторами рекомендуются следующие параметры для занятий: глубина бассейна не менее 1,4 м, температура воды от 32°С до 33,5°С, длительность процедуры – 45–60 минут.
Следует учесть, что повреждения кожи или кожные заболевания являются противопоказанием к проведению ЛФК в общем бассейне. Таким образом, бальнеотерапию, гидротерапию, акватерапию пациентам с лимфедемой конечности можно рекомендовать в комплексных программах реабилитации и при планировании санаторно-курортного лечения с учетом предпочтений пациента и отсутствия противопоказаний, а также в качестве метода лечения в поддерживающую фазу КФПТ.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Диспансерное наблюдение, ранняя диагностика и профилактика прогрессирования лимфедемы
Раннее выявление и лечение лимфедемы может предотвратить ее прогрессирование и снизить негативные психосоциальные и функциональные последствия для пациентов [455].
- Рекомендуется диспансерное наблюдение пациентов группы риска развития лимфедемы с целью выявления субклинической стадии лимфедемы и раннего начала лечебно-профилактических мероприятий и пациентов с лимфедемой конечности с целью контроля состояния конечности и оценки необходимости возобновления лечебных мероприятий с периодичностью не реже 1 раза в год
УДД 3 УУР B [455,456]
Комментарий 1, периодичность. В рамках диспансерного наблюдения рекомендуется осмотр специалиста не реже 1 раза в год или при появлении/ нарастании субъективных симптомов или отека конечности. Диспансерное наблюдение за пациентом с лимфедемой может осуществлять врач, занимающийся лечением пациента с лимфедемой. Объем и характер необходимых диагностических и лечебных мероприятий определяет врач с учетом особенностей клинического случая.
Комментарий 2, предиктивные модели. Существуют предиктивные модели риска развития лимфедемы. В исследовании Soran A. с соавт. 2016 г. модель Cleveland Clinic Risk Calculator для оценки риска развития РМЖ-ассоциированной лимфедемы после операции с диссекцией подмышечных лимфоузлов показала неудовлетворительную точность предсказания, авторы признали более эффективной стратегией периодический врачебный контроль за состоянием конечности [457]. В проспективном исследовании, охватившем 707 пациентов, применение модели Surveillance program for lymphedema management (SLYM) позволило снизить 5-летнюю кумулятивную заболеваемость лимфедемой 3 степени с 15% до 6,4%, чувствительность модели в отношении прогнозирования развития лимфедемы оценена в 60%, специфичность в 61% [458]. В работе Martinez-Jaimez P. с соавт. 2023 г. заявляется о временной валидации разработанной авторами предиктивной модели, однако работа имеет серьезные методологические ограничения [459]. На сегодняшний день нет предиктивных моделей лимфедемы, валидированных в РФ.
Комментарий 3, ранняя диагностика. В проспективном наблюдательном сравнительном исследовании у пациентов после хирургического, лучевого лечения или химиотерапии по поводу РМЖ выявление субклинической лимфедемы и раннее проведение лечебно-профилактических мероприятий позволило на сроке наблюдения до 20 мес. снизить частоту развития лимфедемы с 36,4% до 4,4% [456].
Комментарий 4, особенности наблюдения пациентов группы риска. У пациентов группы риска после хирургического или иного лечения рака в течение первого года после проведения лечения рака целесообразен более частный контроль состояния конечности. Например, может быть предложен осмотр каждые 3 месяца в течение первого года после операции, а затем два раза в год в период до 5 лет. Для диагностики субклинической лимфедемы целесообразно применение инструментальных методов (например, биоимпедансной спектроскопии) и волюметрии. При первых признаках субклинического отека (увеличение объема конечности на 3-5%, данные биоимпедансного анализа) целесообразны активные лечебные мероприятия (активная фаза КФПТ) [460].
5.2. Профилактика развития вторичной лимфедемы.
5.2.1. Группы риска
К группе риска развития вторичной лимфедемы относятся пациенты, подверженные влиянию основных факторов риска ее развития. Как указано в разделе «Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)», к основным факторам риска развития вторичной лимфедемы относятся:
- Рак с поражением путей оттока лимфы из конечности (лимфатические узлы, лимфатические сосуды) в результате сдавления или распространения по ним опухолевого процесса
- Диагностические и лечебные мероприятия по поводу рака с повреждением путей оттока лимфы из конечности (пункция или биопсия лимфоузлов, диссекция лимфоузлов, лучевая терапия и др.);
- Диагностические и лечебные хирургические вмешательства, не связанные с раком (пункция или биопсия лимфоузлов, хирургические операции с вмешательством в зонах расположения лимфатических сосудов и коллекторов и др.);
- Инфекция;
- Ожирение;
- Травма;
- Системные воспалительные заболевания;
- ХВН;
- Филяриоз.
5.2.2. Консервативная профилактика развития вторичной лимфедемы
5.2.2.1. Информирование пациента, самоконтроль и профилактика вторичной лимфедемы
Пациент группы риска развития вторичной лимфедемы далее по тексту обозначается термином «пациент группы риска». Конечность на стороне проведения вмешательства с высоким риском повреждения лимфатической системы именуется как «ипсилатеральная конечность».
- Рекомендуется информировать пациента группы риска об имеющемся риске с целью обеспечения профилактики развития лимфедемы и раннего обращения к специалисту в случае развития вторичной лимфедемы конечности
УДД 4 УУР С [461,462]
Комментарий 1 (информирование). Для реализации данной рекомендации с точки зрения временных ресурсов целесообразно проводить информирование пациентов из группы риска в формате «школы пациента».
Комментарий 2 (раннее обращение). Основным смыслом данной рекомендации является не наложение на пациента каких-либо ограничений, а обеспечение раннего распознавания пациентом симптомов и проявлений лимфедемы и его раннего обращения к врачу. Для этого необходимо ознакомление пациента с факторами, усиливающими нагрузку на лимфатическую систему, и способами их контроля.
Комментарий 3 (самоконтроль). Самостоятельное измерения конечностей дает возможность ранней диагностики развития лимфедемы. В неклиническом исследовании показана высокая точность такого самоконтроля при измерении окружности конечностей [463]. Целесообразно рекомендовать пациенту группы риска измерить окружность обеих конечностей на определенных уровнях до проведения вмешательства с высоким риском повреждения лимфатической системы. После вмешательства необходимо проводить регулярные измерения окружностей конечностей на тех же уровнях (уровни измерения и их регулярность определяется врачом индивидуально). Предпочтительно выполнять измерения в одно и то же время суток (например, только утром), одним и тем же человеком (либо самим пациентом, либо кем-то из родственников). При самоконтроле особое внимание уделяется выявлению изменения разницы длины окружности разных конечностей на одном уровне. Целесообразно рекомендовать пациенту ведение дневника измерений длин окружностей конечностей.
5.2.2.2. Поведенческая профилактика РМЖ-ассоциированной лимфедемы
- Пациентам после хирургического лечения РМЖ рекомендуется воздержаться от медицинских манипуляций (забор крови для анализа, инъекции, измерение артериального давления и т.п.) на верхней конечности на стороне операции с целью профилактики развития вторичной лимфедемы
УДД 5 УУР С [78,464]
Комментарий. Ограничения для пациентов группы риска развития лимфедемы конечности по выполнению медицинских манипуляций на конечности на стороне операции поддержаны в консенсусном практическом руководстве по лимфедеме от 2006 г. и в практическом руководстве от National Lymphedema Network (США) 2012 г. Вместе с тем, польза данных ограничения не получила подтверждения в позднее проведенных исследованиях и в последние годы они подвергнуты критике. В частности, экспертная группа Американского общество хирургов молочной железы на основании данных трех проспективных исследований заключила, что указанные массовые ограничения не обоснованы и нежелательны [27,324,465,466]. При невозможности выполнения манипуляции на противоположной конечности/ через порт-систему пациенту необходимо объяснить риски и способы их снижения и принимать решение о выполнении манипуляции исходя из наличия превышения пользы от нее над возможными рисками. В рекомендациях профессиональных сообществ предлагается обсуждать с пациентом индивидуальные ограничения, способные снизить риск развития вторичной лимфедемы [72,324]. Однако следует отметить, что на сегодняшний день не существует критериев индивидуализации «поведенческих» мер профилактики развития вторичной лимфедемы.
- Пациентам после хирургического лечения РМЖ не рекомендуется ограничивать авиаперелеты с целью профилактики развития вторичной лимфедемы
УДД 2 УУР B [467]
Комментарий. Рекомендации против авиаперелетов для предотвращения развития РМЖ-ассоциированной лимфедемы в значительной степени основаны на одном исследовании с дистанционным анкетированием пациентов [468]. Ряд опубликованных с тех пор исследований опровергли это утверждение [466,469,470]. В исследовании Ferguson CM. с соавт. перелеты не увеличивали риск развития лимфедемы верхней конечности. Уровень значимости различий частоты развития лимфедемы в проведенных сравнениях составил: количество или длительность авиаперелетов: один или два авиаперелета p=0.77; нет авиаперелета или ≥ 3 авиаперелетов p=0.91; авиаперелет продолжительностью 1 или 12 часов p=0.43; нет авиаперелета или авиаперелет свыше 12 часов p=0.54. По данным систематического обзора 2018 г. авиаперелет не является фактором риска развития лимфедемы [467]. В этом систематическом обзоре при анализе 4 исследований с группой контроля установлено, что лимфедема развилась у 107 из 1189 пациентов (9%) с документально подтвержденным анамнезом авиаперелетов и у 204 из 2356 пациентов (8,7%), которые не летали (χ2 тест; p = 0.8). Таким образом, на сегодняшний день нет данных, что авиаперелеты повышают риск развития лимфедемы у пациентов группы риска.
5.2.2.3. Компрессионная терапия и профилактика вторичной лимфедемы
- Рекомендуется рассмотреть целесообразность назначения компрессионного рукава с уровнем давления 15 мм.рт.ст. пациентам после хирургического лечения РМЖ на верхней конечности на стороне операции с целью профилактики развития вторичной лимфедемы
УДД 2 УУР B [471,472]
Комментарий 1. В РКИ 2019 года применение компрессионных рукавов с уровнем давления 15 мм.рт.ст. у пациенток после хирургического лечения РМЖ снизило частоту развития вторичной лимфедемы и привело к значительному улучшению качества жизни и ряда параметров, на него влияющих (функция конечности, утомляемость, боль и другие симптомы) [471]. Формирование лимфедемы фиксировалось при увеличении объема конечности на 10% в сравнении с предоперационными значениями, качество жизни оценивалось по опросникам QLQ-C30 и QLQ-BR23. На сроке в 1 год развитие лимфедемы зафиксировано у 3 из 20 пациенток группы компрессии и у 6 из 21 пациентки группы контроля (без компрессии). В крупном РКИ 2022 г. (307 пациенток) применение компрессии снизило частоту развития вторичной лимфедемы при ее диагностике на основании биоимпедансной спектроскопии и волюметрии (ОР=0.61, 95%ДИ 0.43-0.85, p = 0.004; и ОР=0.56, 95%ДИ 0.33- 0.96, p = 0.034 соответственно) [472]. На сроке наблюдения в 1 год в группе компрессии и контроля частота развития лимфедемы при ее диагностике на основании биоимпедансной спектроскопии и волюметрии составила 42% vs 52% и 14% vs 25% соответственно. В РКИ 2021 г. на сроке наблюдения 2 года после операции по поводу РМЖ не было различий в частоте развития лимфедемы в группе компрессии и контроля (12,1% и 12,5% соответственно) [473]. Однако в группе компрессии частота лимфедемы была значительно ниже (p = 0,02) у пациентов, которые ежедневно использовали компрессионный рукав в соответствии с рекомендациями по сравнению с пациентами, которые не придерживались назначенного регламента компрессионной терапии. Пациенты в группе компрессии были проинструктированы носить компрессионный рукав ≥ 8 ч/день в течение первых 3 месяцев после операции и 2 ч/день в последующем. Эти результаты подчеркивают важность соблюдения назначенного режима компрессионной профилактики.
Комментарий 2. Компрессионный трикотаж как на верхних, так и на нижних конечностях с целью профилактики развития лимфедемы целесообразно носить, как минимум, в периоды повышения лимфатической нагрузки и при повышении риска тромбообразования – при физической нагрузке (спорт, уборка и пр.) и в течение часа после нее, во время длительных перелетов (в течение всего полета и часа после него), при нахождении в условиях жары, после медицинских манипуляциях на компрометированной конечности. Для верхней конечности целесообразно использовать рукав круглой вязки от запястья до подмышечной области с капельной резинкой без лент через плечо с уровнем давления 15 – 20 мм.рт.ст. Для нижних конечностей (после лечения онкологических заболеваний малого таза и т.п.) – чулки (или, при необходимости, колготы) круглой вязки с уровнем давления 15–30 мм.рт.ст. Модель, размер, уровень компрессии, режим ношения целесообразно подбирать под руководством медицинского специалиста по лечению лимфедемы.
5.2.2.4. Экстремальная температура и профилактика вторичной лимфедемы
Во многих практических руководствах по лечению лимфедемы, выпускаемых различными некоммерческими организациями (например, The National Lymphoedema Network, The International Lymphoedema Framework) пациентам с лимфедемой или риском ее развития рекомендуется избегать экстремальных (низких или высоких) температур, в частности нахождения в бане, сауне, под прямыми солнечными лучами и т.п. Пациенту с лимфедемой следует рекомендовать избегать воздействия сильного жара или холода, т.е. любого изменения температуры, которое сопровождается значительной гиперемией кожи. Повреждения тканей по типу ожогов или обморожений представляют значительную опасность для пациента с лимфедемой.
5.2.2.5. Сауны, паровые бани или джакузи и профилактика вторичной лимфедемы
Субанализ РКИ от 2012 г., посвященного изучению физической активности и лимфедемы, был первым и, по-видимому, единственным доказательством того, что посещение сауны увеличивает риск развития РМЖ-ассоциированной лимфедемы [465]. Авторы указанного субанализа выступали за то, чтобы рекомендовать пациентам, перенесшим хирургическое лечение РМЖ, воздерживаться от посещения саун, вместе с тем полученный ими результат можно отнести к доказательствам низкого качества.
В отельных рекомендациях профессиональных сообществ, рассматривающих данный вопрос, предлагается [72]:
- При наличии повреждений кожи больной конечности (раны, порезы, ссадины), пациентам с лимфедемой и пациентам группы риска развития лимфедемы рекомендуется избегать посещение саун, паровых бань или джакузи ввиду высокого риска развития целлюлита;
- Пациентов группы риска развития лимфедемы без повреждений кожи следует информировать об отсутствии качественных доказательств наличия или отсутствия риска развития лимфедемы при посещении саун, паровых бань или джакузи.
5.2.2.6. Снижение веса, контроль веса и профилактика вторичной лимфедемы
Как указано в разделе «Эпидемиология заболевания или состояния (группы заболеваний или состояний)»/ «Лимфедема, связанная с лечением рака – эпидемиология по типам рака», ожирение является независимым (самостоятельным) фактором риска развития лимфедемы у пациенток, прошедших лечение по поводу РМЖ. С учетом убедительных доказательств этого положения представляется логичным, что снижение веса после операции по поводу РМЖ может уменьшить риск развития вторичной лимфедемы. Вместе с тем, в крупном проспективном когортном исследовании от 2021 г. установлено, что изолированно снижение веса само по себе не защищало от развития РМЖ-ассоциированной лимфедемы (ОР = 1.38; 95%ДИ 0.89–2.13; p = 0.15) [474]. Всего в этом исследовании наблюдалось 1161 пациентка, среднее время наблюдения составило 49 мес., основным исходом являлось увеличение объема ипсилатеральной (по отношению к зоне операции) конечности ≥10%, объем конечности оценивался с помощью оптоэлектронного перометра. Всего лимфедема развилась у 92 пациенток (7,9%).
Таким образом, хотя снижение веса само по себе может не уменьшить риск развития вторичной лимфедемы после лечения РМЖ, оно может быть рекомендовано как часть индивидуальной программы модификации образа жизни для улучшения общего состояния здоровья и повышения качества жизни. С этой целью снижение веса может быть рекомендовано в программах профилактики развития вторичной лимфедемы любого генеза.
5.2.2.7. ЛФК, физические нагрузки и профилактика вторичной лимфедемы
В исследованиях и систематических обзорах по применению ЛФК после оперативного лечения РМЖ рассматривается несколько вопросов: эффективность ЛФК в профилактике развития вторичной лимфедемы, риск провоцирования развития лимфедемы при проведении ЛФК, эффективность ЛФК при сформировавшей вторичной лимфедеме. Так эти вопросы очень тесно взаимосвязаны, они подробно рассмотрены в разделе: «Консервативное лечение лимфедемы» / «КФПТ: ЛФК, физические упражнения» / «ЛФК у пациентов с лимфедемой, перенесших хирургическое вмешательство в зоне лимфатических путей конечности». Основные положения, касающиеся профилактики развития вторичной лимфедемы:
- ЛФК рекомендуется как компонент КФПТ у пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) с целью профилактики развития лимфедемы (представлены обоснования уровня УДД 2 УУР B);
- ЛФК рекомендуется как безопасное средство у пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) и получающих противоопухолевую терапию (представлены обоснования уровня УДД 3 УУР B);
- Рекомендуется рассмотреть целесообразность использования компрессионного трикотажа во время ЛФК у пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности (в частности, операцию по поводу РМЖ) при отсутствии лимфедемы с целью профилактики ее развития (представлены обоснования уровня УДД 2 УУР B).
5.2.3. Хирургическая профилактика развития вторичной лимфедемы
В случае принятия решения о хирургической профилактике развития вторичной лимфедемы следует принять во внимание следующие особенности [324,475–478]:
- Предлагается накладывать профилактические лимфовенозные анастомозы по телескопической технике F.M. Boccardo одновременно с процедурой аксиллярной лимфодиссекции. Процедура наложения профилактических лимфовенозных анастомозов рекомендована даже тогда, когда аксиллярная лимфодиссекция выполнялся с использованием техники обратного картирования подмышечных впадин. Это обусловлено тем, что даже при картировании почти невозможно идентифицировать лимфатические узлы на эфферентных сосудах, действительно участвующих в лимфоотоке из конечности, так как лимфодренаж от руки и груди осуществляется по общим лимфатическим путям;
- Предлагается накладывать как телескопические лимфовенозные анастомозы по технике F.M. Boccardo, так и профилактические лимфовенозные (лимфовенулярные) анастомозы с использованием микрохирургической техники (по технике J.Masia, протокол T-LAR). Эти техники являются взаимодополняющими, так как имеют свои преимущества и недостатки. Телескопическая техника лимфовенозного анастомоза предполагает соединение лимфатических и венозных сосудов в ортотопическом положении, сокращает время наложения анастомоза до 30 минут, но имеет риск развития венозно-лимфатического рефлюкса и тромбоза из-за использования крупной вены. Лимфовенозные (лимфовенулярные) анастомозы с использованием современной микрохирургической техники зарекомендовали себя, как конкурентоспособный метод. Несмотря на гетеротопическое расположение анастомозов процент развития лимфедемы ниже, чем при телескопической технике. Недостатком лимфовенозных (лимфовенулярных) анастомозов в сравнении с телескопической техникой является большее время операции, которое может достигать 2-х часов;
6. Организация оказания медицинской помощи
Организация оказания медицинской помощи пациентам лимфедемой конечностей регламентирована действующим приказом Министерства Здравоохранения Российской Федерации (от 15 ноября 2012 г. N 922н) и оказывается в соответствии с установленным порядком. Медицинская помощь лицам с лимфедемой конечностей или ее осложнениями, а также при подозрении на указанные состояния может осуществляться в виде первичной медико-санитарной помощи, скорой, в том числе скорой специализированной, медицинской помощи, специализированной, в том числе высокотехнологичной, медицинской помощи. Медицинская помощь может оказываться в амбулаторно (то есть в условиях, не предусматривающих круглосуточного медицинского наблюдения и лечения); стационарно (при наличии показаний для обеспечения круглосуточного медицинского наблюдения и лечения), либо в условиях дневного стационара (в условиях, предусматривающих медицинское наблюдение и лечение в дневное время, не требующих круглосуточного медицинского наблюдения и лечения).
Для большинства пациентов с установленным диагнозом лимфедема конечностей возможно амбулаторное лечение. Решение о необходимости госпитализации должно приниматься лечащим врачом индивидуально, исходя из стадии лимфедемы и возможности пациента получать лечение амбулаторно или в условиях дневного стационара, тяжести осложнений лимфедемы, наличия сопутствующей патологии, доступности хирургических методов лечения.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- При наличии разработанных профессиональными ассоциациями программ для самостоятельного лечения лимфедемы, рекомендуется ориентировать пациентов на их использование в поддерживающую фазу лечения лимфедемы для сохранения результата лечения и предупреждения прогрессирования заболевания.
УДД 1 УУР B [479]
Комментарий. Лимфедема является неизлечимым заболеванием, лечение которого высокозатратно для как для пациента, так и для здравоохранения. Поэтому крайне важным является профилактика развития вторичной лимфедемы при онкологических заболеваниях, филяриозе и других инфекциях, а также сохранение результата лечения и предупреждение прогрессирования лимфедемы. Существуют доказавшие свою эффективность специальные программы для самостоятельной профилактики лимфедемы у пациентов с раком молочной железы (SMLEP и SMLP) [479–481]. Учитывая схожий патогенез лимфедемы при любом этиологическом факторе, возможно применение данных программ у любой категории пациентов с лимфедемой. Целесообразно, при наличии такой возможности, предоставить пациенту обучающий буклет, содержащий информацию по заболеванию, программу упражнений и дневник для самоконтроля. В разделе информации о заболевании предпочтительно освещение следующих вопросов:
− симптомы и признаки лимфедемы;
− факторы риска развития и прогрессирования лимфедемы;
− оценка выраженности лимфедемы;
− профилактика инфекционных осложнений;
− уход за кожей;
− защита от травм;
− контроль веса;
− физические упражнения;
- Пациенткам с вторичной лимфедемой, связанной с раком молочной железы, при отсутствии активности рака и отсутствии необходимости проведения противоопухолевой терапии, рекомендуется снижение веса с помощью индивидуальных рекомендаций по питанию с целью повышения эффективности уменьшения лимфатического отека при компрессионной терапии
УДД 2 УУР B [383]
Комментарий. В РКИ продемонстрировано, что снижение суточного потребления калорий до 1000–1200 ккал (4184–5020 кДж) за счет сокращения в рационе доли рафинированных углеводов и жиров, привело к более эффективному уменьшению лимфатического отека на фоне терапии с помощью компрессионного трикотажа [383]. Критериями включения в исследование были: ремиссия рака, отсутствие необходимости проведения химиотерапии или лучевой терапии.
Критерии оценки качества медицинской помощи
|
№ |
Критерий качества |
УДД |
УУР |
|
Этап постановки диагноза |
|||
|
1 |
Выполнено клиническое обследование пациента (сбор жалоб, анамнеза, осмотр, пальпация нижних конечностей) |
5 |
С |
|
2 |
Выполнена количественная оценка отека конечности пациента с лимфедемой (измерения) |
5 |
С |
|
Этап лечения |
|||
|
3 |
При наличии показаний проведена активная фаза КФПТ |
5 |
С |
|
4 |
При отсутствии показаний к проведению активной фазы КФПТ рекомендовано проведение поддерживающей фазы КФПТ |
5 |
С |
|
Этап контроля |
|||
|
5 |
Пациенту группы риска или пациенту с лимфедемой конечности рекомендовано диспансерное наблюдение |
5 |
С |
|
6 |
На контрольном визите выполнена количественная оценка отека конечности пациента с лимфедемой (измерения) |
5 |
С |
|
7 |
При появлении показаний назначена активная фаза КФПТ |
5 |
С |
Список литературы
- Greene A., Slavin S., Brorson H. Epidemiology and morbidity of lymphedema // Lymphedema Presentation, Diagnosis, and Treatment / ed. Greene Arin. Springer Cham, 2015. P. 33–44.
- Kerchner K., Fleischer A., Yosipovitch G. Lower extremity lymphedema update: pathophysiology, diagnosis, and treatment guidelines // J Am Acad Dermatol. J Am Acad Dermatol, 2008. Vol. 59, № 2. P. 324–331.
- Bubnova N.A., Borisova R.P., Kubyshkina N.A. Theory of active lymph transport: morphofunctional foundations and clinical aspects // Regional blood circulation and microcirculation. 2020. Vol. 19, № 3. P. 80–89.
- Breslin J.W., Yang Y., Scallan J.P., Sweat R.S., Adderley S.P., Murfee W.L. Lymphatic Vessel Network Structure and Physiology // Compr Physiol. Wiley, 2018. P. 207–299.
- Поташов Л.В., Бубнова Н.А., Орлов Р.С., Борисов А.В., Борисова Р.П., Петров С.В. Хирургическая лимфология / ed. Поташов Л.В. Издательство СПбГЭТУ “ЛЭТИ,” 2002. 273 p.
- Борисов А.В. Анатомия лимфангиона. Нальчик: Полиграфсервис, 2007. 296 p.
- Бубнова Н.А., Борисова Р.П. Значение лимфангиона как структурно - функциональной единицы в новой теории структуры и функции лимфатической системы // Вестник лимфологии. 2010. Vol. 4. P. 32–36.
- Olszewski WL. Lymph stasis: pathophysiology, giagnosis and treatment. CRC Press, 1991. 648 p.
- Mortimer P. The pathophysiology of lymphedema // Cancer. 1998. Vol. 83, № 12 Suppl American. P. 2798–2802.
- Földi M., Földi E., Strößenreuther C., Kubik S. Földi’s Textbook of Lymphology: for Physicians and Lymphedema Therapists. 3rd ed. Elsevier Health Sciences, 2012. 672 p.
- Gordon K., Mortimer P.S., van Zanten M., Jeffery S., Ostergaard P., Mansour S. The St George’s Classification Algorithm of Primary Lymphatic Anomalies // Lymphat Res Biol. 2021. Vol. 19, № 1. P. 25–30.
- Dean S.M., Starr J. An unusual case of familial lymphedema // Ann Vasc Surg. 2014. Vol. 28, № 5. P. 1314.e1-3.
- Brouillard P., Boon L., Vikkula M. Genetics of lymphatic anomalies // J Clin Invest. 2014. Vol. 124, № 3. P. 898–904.
- Jones G.E., Mansour S. An approach to familial lymphoedema // Clin Med (Lond). 2017. Vol. 17, № 6. P. 552–557.
- Ferrell R.E., Baty C.J., Kimak M.A., Karlsson J.M., Lawrence E.C., Franke-Snyder M., Meriney S.D., Feingold E., Finegold D.N. GJC2 Missense Mutations Cause Human Lymphedema // Am J Hum Genet. 2010. Vol. 86, № 6. P. 943–948.
- Gordon K., Spiden S.L., Connell F.C., Brice G., Cottrell S., Short J., Taylor R., Jeffery S., Mortimer P.S., Mansour S., Ostergaard P. FLT4/VEGFR3 and Milroy disease: novel mutations, a review of published variants and database update // Hum Mutat. 2013. Vol. 34, № 1. P. 23–31.
- Mendola A., Schlögel M.J., Ghalamkarpour A., Irrthum A., Nguyen H.L., Fastré E., Bygum A., van der Vleuten C., Fagerberg C., Baselga E., Quere I., Mulliken J.B., Boon L.M., Brouillard P., Vikkula M. Mutations in the VEGFR3 Signaling Pathway Explain 36% of Familial Lymphedema // Mol Syndromol. 2013. Vol. 4, № 6. P. 257–266.
- Kaipainen A., Korhonen J., Mustonen T., van Hinsbergh V.W., Fang G.H., Dumont D., Breitman M., Alitalo K. Expression of the fms-like tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development // Proc Natl Acad Sci U S A. 1995. Vol. 92, № 8. P. 3566–3570.
- Monaghan R.M., Page D.J., Ostergaard P., Keavney B.D. The physiological and pathological functions of VEGFR3 in cardiac and lymphatic development and related diseases // Cardiovasc Res. 2021. Vol. 117, № 8. P. 1877–1890.
- Dai T., Li B., He B., Yan L., Gu L., Liu X., Qi J., Li P., Zhou X. A novel mutation in the conserved sequence of vascular endothelial growth factor receptor 3 leads to primary lymphoedema // J Int Med Res. 2018. Vol. 46, № 8. P. 3162–3171.
- Kitsiou-Tzeli S., Vrettou C., Leze E., Makrythanasis P., Kanavakis E., Willems P. Milroy’s primary congenital lymphedema in a male infant and review of the literature // In Vivo (Brooklyn). 2010. Vol. 24, № 3. P. 309–314.
- Cariati M., Bains S.K., Grootendorst M.R., Suyoi A., Peters A.M., Mortimer P., Ellis P., Harries M., Van Hemelrijck M., Purushotham A.D. Adjuvant taxanes and the development of breast cancer-related arm lymphoedema // Br J Surg. 2015. Vol. 102, № 9. P. 1071–1078.
- Gillespie T.C., Sayegh H.E., Brunelle C.L., Daniell K.M., Taghian A.G. Breast cancer-related lymphedema: risk factors, precautionary measures, and treatments // Gland Surg. 2018. Vol. 7, № 4. P. 379–403.
- Göker M., Devoogdt N., Van de Putte G., Schobbens J.C., Vlasselaer J., Van den Broecke R., de Jonge E.T.M. Systematic review of breast cancer related lymphoedema: making a balanced decision to perform an axillary clearance // Facts Views Vis Obgyn. 2013. Vol. 5, № 2. P. 106–115.
- Norman S.A., Localio A.R., Kallan M.J., Weber A.L., Torpey H.A.S., Potashnik S.L., Miller L.T., Fox K.R., DeMichele A., Solin L.J. Risk factors for lymphedema after breast cancer treatment // Cancer Epidemiol Biomarkers Prev. 2010. Vol. 19, № 11. P. 2734–2746.
- Cormier J.N., Askew R.L., Mungovan K.S., Xing Y., Ross M.I., Armer J.M. Lymphedema beyond breast cancer: a systematic review and meta-analysis of cancer-related secondary lymphedema // Cancer. 2010. Vol. 116, № 22. P. 5138–5149.
- Kilbreath S.L., Refshauge K.M., Beith J.M., Ward L.C., Ung O.A., Dylke E.S., French J.R., Yee J., Koelmeyer L., Gaitatzis K. Risk factors for lymphoedema in women with breast cancer: A large prospective cohort // Breast. 2016. Vol. 28. P. 29–36.
- Dayan J.H., Ly C.L., Kataru R.P., Mehrara B.J. Lymphedema: Pathogenesis and Novel Therapies // Annu Rev Med. 2018. Vol. 69. P. 263–276.
- Jeruss J.S., Winchester D.J., Sener S.F., Brinkman E.M., Bilimoria M.M., Barrera E., Alwawi E., Schermerhorn M.G., Winchester D.P. Axillary recurrence following sentinel node biopsy // Ann Surg Oncol. 2004. Vol. 11, № S2. P. S58–S58.
- DiSipio T., Rye S., Newman B., Hayes S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis // Lancet Oncol. 2013. Vol. 14, № 6. P. 500–515.
- Cabanas R.M. An approach for the treatment of penile carcinoma // Cancer. 1977. Vol. 39, № 2. P. 456–466.
- Morton D.L., Wen D.R., Wong J.H., Economou J.S., Cagle L.A., Storm F.K., Foshag L.J., Cochran A.J. Technical details of intraoperative lymphatic mapping for early stage melanoma // Arch Surg. 1992. Vol. 127, № 4. P. 392–399.
- Suami H., Yamashita S., Soto-Miranda M.A., Chang D.W. Lymphatic territories (lymphosomes) in a canine: an animal model for investigation of postoperative lymphatic alterations // PLoS One. 2013. Vol. 8, № 7. P. e69222.
- Suami H. Lymphosome concept: Anatomical study of the lymphatic system // J Surg Oncol. 2017. Vol. 115, № 1. P. 13–17.
- Suami H., Kato S. Anatomy of the Lymphatic System and Its Structural Disorders in Lymphoedema // Lymphedema. Cham: Springer International Publishing, 2018. P. 57–78.
- Курочкина О.С., Байтингер В.Ф., Дудников А.В. Анатомия лимфатического русла верхней конечности: лимфодренаж от верхней конечности в норме и после подмышечной лимфодиссекции // Вопросы реконструктивной и пластической хирургии. 2018. Vol. 82, № 3. P. 131–138.
- Rockson S.G. Lymphedema after Breast Cancer Treatment // N Engl J Med. 2018. Vol. 379, № 20. P. 1937–1944.
- Topuzov E.E., Agishev T.T., Bozhok A.A., Dashyan G.A., Sadygova S.N., Prikhod’ko E. V., Arshba E.A. Clinical and morphological characteristics of skin and subcutaneous fat damage after surgical treatment and radiation therapy in patients with breast cancer (literature review) // Tumors of female reproductive system. 2017. Vol. 13, № 1. P. 25–33.
- Westbury C.B., Yarnold J.R. Radiation fibrosis--current clinical and therapeutic perspectives // Clin Oncol. 2012. Vol. 24, № 10. P. 657–672.
- Ohsumi S., Shimozuma K., Ohashi Y., Takeuchi A., Suemasu K., Kuranami M., Ohno S., Watanabe T. Subjective and objective assessment of edema during adjuvant chemotherapy for breast cancer using taxane-containing regimens in a randomized controlled trial: The National Surgical Adjuvant Study of Breast Cancer 02 // Oncology. 2012. Vol. 82, № 3. P. 131–138.
- Hidding J.T., Beurskens C.H.G., van der Wees P.J., Bos W.C.A.M., Nijhuis-van der Sanden M.W.G., van Laarhoven H.W.M. Changes in volume and incidence of lymphedema during and after treatment with docetaxel, doxorubicin, and cyclophosphamide (TAC) in patients with breast cancer // Support Care Cancer. 2018. Vol. 26, № 5. P. 1383–1392.
- Dyring-Andersen B., Skov L., Jensen P. Chronic lymphoedema caused by recurrent infections in a patient with allergic hand eczema // Dermatol Reports. 2011. Vol. 3, № 1. P. e11.
- Proske S., Uter W., Schwanitz H.J. Lymphedema of the hand following recurrent erysipelas secondary to fissured irritant contact dermatitis // Contact Dermatitis. 2000. Vol. 42, № 6. P. 368–369.
- Tandon R., Garg M.C., Bajpai H.S. Unilateral upperlimb oedema with ipsilateral tubercular axillary lymphadenitis and miliary tuberculosis // J Assoc Physicians India. 1987. Vol. 35, № 2. P. 149–150.
- Kaur M., Asati D.P., Khurana U., Patra S. Unilateral lymphoedema of lower limb: an unusual presenting feature of hidden tuberculosis verrucosa cutis of foot // BMJ Case Rep. 2020. Vol. 13, № 11.
- Greene A.K., Grant F.D., Slavin S.A. Lower-extremity lymphedema and elevated body-mass index // N Engl J Med. 2012. Vol. 366, № 22. P. 2136–2137.
- Mehrara B.J., Greene A.K. Lymphedema and obesity: is there a link? // Plast Reconstr Surg. 2014. Vol. 134, № 1. P. 154e–160e.
- Wagner J.M., Grolewski V., Reinkemeier F., Drysch M., Schmidt S.V., Dadras M., Huber J., Wallner C., Sogorski A., von Glinski M., Schildhauer T.A., Lehnhardt M., Behr B. Posttraumatic Lymphedema after Open Fractures of the Lower Extremity-A Retrospective Cohort Analysis // J Pers Med. 2021. Vol. 11, № 11.
- Liao C.D., Kuruvilla A.S., Krajewski A. A scoping literature review of post-traumatic lymphedema: Where are we now? // J Plast Reconstr Aesthet Surg. 2022. Vol. 75, № 7. P. 2387–2440.
- Anand S., Lal H., Dhaon B.K. Lymphedema of the lower extremity as a complication of local burns // Burns. 1998. Vol. 24, № 8. P. 767–769.
- Hettrick H., Nof L., Ward S., Ecthernach J. Incidence and prevalence of lymphedema in patients following burn injury: a five-year retrospective and three-month prospective study // Lymphat Res Biol. 2004. Vol. 2, № 1. P. 11–24.
- Warren A.G., Slavin S.A. Scar lymphedema: fact or fiction? // Ann Plast Surg. 2007. Vol. 59, № 1. P. 41–45.
- Lessiani G., Iodice P., Nicolucci E., Gentili M. Lymphatic edema of the lower limbs after orthopedic surgery: results of a randomized, open-label clinical trial with a new extended-release preparation // J Biol Regul Homeost Agents. 2015. Vol. 29, № 4. P. 805–812.
- Joos E., Bourgeois P., Famaey J.P. Lymphatic disorders in rheumatoid arthritis // Semin Arthritis Rheum. 1993. Vol. 22, № 6. P. 392–398.
- Sant S.M., Tormey V.J., Freyne P., Casey E.B. Lymphatic obstruction in rheumatoid arthritis // Clin Rheumatol. 1995. Vol. 14, № 4. P. 445–450.
- Kiely P.D., Joseph A.E., Mortimer P.S., Bourke B.E. Upper limb lymphedema associated with polyarthritis of rheumatoid type // J Rheumatol. 1994. Vol. 21, № 6. P. 1043–1045.
- Mulherin D.M., FitzGerald O., Bresnihan B. Lymphedema of the upper limb in patients with psoriatic arthritis // Semin Arthritis Rheum. 1993. Vol. 22, № 5. P. 350–356.
- Salvarani C., Cantini F., Olivieri I., Niccoli L., Senesi C., Macchioni L., Boiardi L., Padula A. Distal extremity swelling with pitting edema in psoriatic arthritis: evidence of 2 pathological mechanisms // J Rheumatol. 1999. Vol. 26, № 8. P. 1831–1834.
- Lekpa F.K., Economu-Dubosc A., Fevre C., Claudepierre P., Chevalier X. Efficacy of etanercept in lymphedema associated with psoriatic arthritis // J Rheumatol. 2009. Vol. 36, № 1. P. 207–208.
- Böhm M., Riemann B., Luger T.A., Bonsmann G. Bilateral upper limb lymphoedema associated with psoriatic arthritis: a case report and review of the literature // Br J Dermatol. 2000. Vol. 143, № 6. P. 1297–1301.
- Schmit P., Prieur A.M., Brunelle F. Juvenile rheumatoid arthritis and lymphoedema: lymphangiographic aspects // Pediatr Radiol. 1999. Vol. 29, № 5. P. 364–366.
- Minari C., Cecconami L., Fioravanti A., Montemerani M., Scola C., Marcolongo R. Lymphoedema of the limbs in rheumatoid arthritis // Clin Rheumatol. 1994. Vol. 13, № 3. P. 464–469.
- Fitzgerald D.A., English J.S. Lymphoedema of the hands as a complication of chronic allergic contact dermatitis // Contact Dermatitis. 1994. Vol. 30, № 5. P. 310.
- Lynde C.W., Mitchell J.C. Unusual complication of allergic contact dermatitis of the hands -- recurrent lymphangitis and persistent lymphoedema // Contact Dermatitis. 1982. Vol. 8, № 4. P. 279–280.
- Hidalgo Calleja C., Cuesta Andrés M., Llorente Melero M.J., Espinosa Castelló A., Balsa Criado A., Gijón Baños J. Lymphoscintigraphic study in a case of rheumatoid arthritis-related lymphoedema // Clin Exp Rheumatol. 1993. Vol. 11, № 4. P. 421–423.
- Lurie F., Malgor R.D., Carman T., Dean S.M., Iafrati M.D., Khilnani N.M., Labropoulos N., Maldonado T.S., Mortimer P., O’Donnell T.F., Raffetto J.D., Rockson S.G., Gasparis A.P. The American Venous Forum, American Vein and Lymphatic Society and the Society for Vascular Medicine expert opinion consensus on lymphedema diagnosis and treatment // Phlebology. Phlebology, 2022. Vol. 37, № 4. P. 252–266.
- Rooke T.W., Felty C.L., Peller P.J., Friese J.L., Lindgren E.A., Bender C.E., Dean S.M., Mohan A.T., Saint-Cyr M., Huang Y., Duncan A., Oderich G., Gloviczki P. Lymphedema // Handbook of Venous and Lymphatic Disorders / ed. Gloviczki P. et al. CRC Press, 2017. P. 707–759.
- Lee B.B., et al. Diagnosis and treatment of primary lymphedema. Consensus document of the International Union of Phlebology (IUP)-2013 // Int Angiol. 2013. Vol. 32, № 6. P. 541–574.
- Babu S., Nutman T.B. Immunopathogenesis of lymphatic filarial disease // Semin Immunopathol. 2012. Vol. 34, № 6. P. 847–861.
- U.S. Department of Health & Human Services. Lymphatic Filariasis: Epidemiology & Risk Factors [Электронный ресурс]. 2021. URL: https://www.cdc.gov/parasites/lymphaticfilariasis/epi.html (дата обращения:15.10.2023).
- Чибрикова Л.М., Субботина В.Г., Павлищева И.Д., Сушкова Н.В., Чибрикова Ю.А., Абдуразакова А.О. Филяриоз. Случай из практики // Междунар. журн. прикладных и фундаментальных исследований. 2016. Vol. 3, № 4. P. 595–598.
- Rankin J., Morris K., Reilly A. The All-Ireland Guidelines for the diagnosis, assessment and management of lymphoedema // Br J Community Nurs. 2022. Vol. 27, № Sup10. P. S22–S26.
- Повещенко А.Ф., Нимаев В.В., Любарский М.С., Коненков В.И. Медицинские и генетические аспекты лимфедемы // Медицинская генетика. 2010. Vol. 9, № 99. P. 3–9.
- Сайк О.В., Нимаев В.В., Усмонов Д.Б., Деменков П.С., Лаврик И.Н., Иванисенко В.А. Гены эндотелиального апоптоза как кандидаты для исследования их связи с лимфедемой // Международный журнал гуманитарных и естественных наук. 2018. Vol. 10, № 1. P. 22–27.
- Newman B., Lose F., Kedda M.-A., Francois M., Ferguson K., Janda M., Yates P., Spurdle A.B., Hayes S.C. Possible genetic predisposition to lymphedema after breast cancer // Lymphat Res Biol. 2012. Vol. 10, № 1. P. 2–13.
- Leung G., Baggott C., West C., Elboim C., Paul S.M., Cooper B.A., Abrams G., Dhruva A., Schmidt B.L., Kober K., Merriman J.D., Leutwyler H., Neuhaus J., Langford D., Smoot B.J., Aouizerat B.E., Miaskowski C. Cytokine candidate genes predict the development of secondary lymphedema following breast cancer surgery // Lymphat Res Biol. 2014. Vol. 12, № 1. P. 10–22.
- Finegold D.N., Baty C.J., Knickelbein K.Z., Perschke S., Noon S.E., Campbell D., Karlsson J.M., Huang D., Kimak M.A., Lawrence E.C., Feingold E., Meriney S.D., Brufsky A.M., Ferrell R.E. Connexin 47 mutations increase risk for secondary lymphedema following breast cancer treatment // Clin Cancer Res. 2012. Vol. 18, № 8. P. 2382–2390.
- British Lymphology Society, Centre for Research and Implementation of Clinical Practice T.V.U., King’s Fund, Lymphoedema Support Network (LSN), Members of the International Advisory Board Participating UK NHS Primary Care Trusts. Lymphoedema Framework. Best Practice for the Management of Lymphoedema. International consensus. MEP Ltd, 2006.
- Choi I., Lee S., Hong Y.-K. The new era of the lymphatic system: no longer secondary to the blood vascular system // Cold Spring Harb Perspect Med. 2012. Vol. 2, № 4. P. a006445.
- Dale R.F. The inheritance of primary lymphoedema // J Med Genet. 1985. Vol. 22, № 4. P. 274–278.
- Nitti M., Hespe G., Cuzzone D. Definition, incidence and pathophysiology of lymphedema // Principles and Practice of Lymphedema Surgery. Elsevier Health Sciences, 2015. P. 40.
- Williams S.K., Rabbani F. Complications of lymphadenectomy in urologic surgery // Urol Clin North Am. 2011. Vol. 38, № 4. P. 507–518, vii.
- Abu-Rustum N.R., Alektiar K., Iasonos A., Lev G., Sonoda Y., Aghajanian C., Chi D.S., Barakat R.R. The incidence of symptomatic lower-extremity lymphedema following treatment of uterine corpus malignancies: a 12-year experience at Memorial Sloan-Kettering Cancer Center // Gynecol Oncol. 2006. Vol. 103, № 2. P. 714–718.
- Rockson S.G., Rivera K.K. Estimating the population burden of lymphedema // Ann N Y Acad Sci. 2008. Vol. 1131. P. 147–154.
- Erickson V.S., Pearson M.L., Ganz P.A., Adams J., Kahn K.L. Arm edema in breast cancer patients // J Natl Cancer Inst. 2001. Vol. 93, № 2. P. 96–111.
- Wang L., Chen H., Li Y., Wang H., Liu N., Yu M., Shang S. Body mass index increases the risk of breast cancer-related lymphedema at 6-18 months after surgery: a retrospective study // Support Care Cancer. 2023. Vol. 31, № 5. P. 278.
- Helyer L.K., Varnic M., Le L.W., Leong W., McCready D. Obesity is a risk factor for developing postoperative lymphedema in breast cancer patients // Breast J. 2010. Vol. 16, № 1. P. 48–54.
- McLaughlin S.A., Wright M.J., Morris K.T., Giron G.L., Sampson M.R., Brockway J.P., Hurley K.E., Riedel E.R., Van Zee K.J. Prevalence of Lymphedema in Women With Breast Cancer 5 Years After Sentinel Lymph Node Biopsy or Axillary Dissection: Objective Measurements // J Clin Oncol. 2008. Vol. 26, № 32. P. 5213–5219.
- Ridner S.H., Dietrich M.S., Stewart B.R., Armer J.M. Body mass index and breast cancer treatment-related lymphedema // Support Care Cancer. 2011. Vol. 19, № 6. P. 853–857.
- Kuroda K., Yamamoto Y., Yanagisawa M., Kawata A., Akiba N., Suzuki K., Naritaka K. Risk factors and a prediction model for lower limb lymphedema following lymphadenectomy in gynecologic cancer: a hospital-based retrospective cohort study // BMC Womens Health. 2017. Vol. 17, № 1. P. 50.
- Hayes S.C., Janda M., Ward L.C., Reul-Hirche H., Steele M.L., Carter J., Quinn M., Cornish B., Obermair A. Lymphedema following gynecological cancer: Results from a prospective, longitudinal cohort study on prevalence, incidence and risk factors // Gynecol Oncol. 2017. Vol. 146, № 3. P. 623–629.
- Colicchia M., Sharma V., Abdollah F., Briganti A., Jeffrey Karnes R. Therapeutic Value of Standard Versus Extended Pelvic Lymph Node Dissection During Radical Prostatectomy for High-Risk Prostate Cancer // Curr Urol Rep. 2017. Vol. 18, № 7. P. 51.
- Keegan K.A., Cookson M.S. Complications of pelvic lymph node dissection for prostate cancer // Curr Urol Rep. 2011. Vol. 12, № 3. P. 203–208.
- Hyngstrom J.R., Chiang Y.-J., Cromwell K.D., Ross M.I., Xing Y., Mungovan K.S., Lee J.E., Gershenwald J.E., Royal R.E., Lucci A., Armer J.M., Cormier J.N. Prospective assessment of lymphedema incidence and lymphedema-associated symptoms following lymph node surgery for melanoma // Melanoma Res. 2013. Vol. 23, № 4. P. 290–297.
- Dean S.M., Kaffenberger B.H., Lustberg M.E. Kaposi sarcoma: An unconventional cause of lower extremity lymphedema // Vasc Med. 2017. Vol. 22, № 6. P. 544.
- Allen P.J., Gillespie D.L., Redfield R.R., Gomez E.R. Lower extremity lymphedema caused by acquired immune deficiency syndrome-related Kaposi’s sarcoma: case report and review of the literature // J Vasc Surg. 1995. Vol. 22, № 2. P. 178–181.
- Онищенко Г. О заболеваемости редкими гельминтозами в Российской Федерации [Электронный ресурс] // Письмо №01/13787-0-32 от 04.09.2010. 2010. URL: http://06.rospotrebnadzor.ru/content/pismo-ot-04092010-no0113787-0-32-o-zabolevaemosti-redkimi-gelmintozami-v-rossiyskoy (дата обращения:15.10.2023).
- Executive Committee of the International Society of Lymphology. The diagnosis and treatment of peripheral lymphedema: 2020 Consensus Document of the International Society of Lymphology // Lymphology. 2020. Vol. 53, № 1. P. 3–19.
- Клиническая ангиология: Руководство / ed. Покровский А.В. Москва: ОАО «Издательство «Медицина», 2004. Vol. 2. 888 p.
- American Physical Therapy Association. Guide to Physical Therapist Practice. Second Edition. American Physical Therapy Association // Phys Ther. 2001. Vol. 81, № 1. P. 9–746.
- Lurie F., et al. The 2020 update of the CEAP classification system and reporting standards // J Vasc Surg Venous Lymphat Disord. 2020. Vol. 8, № 3. P. 342–352.
- Ассоциация флебологов России. Генератор CEAP [Электронный ресурс]. 2020. URL: https://phlebounion.ru/phlebologist/generator-ceap (дата обращения:15.10.2023).
- Nitti M., Hespe G.E., Cuzzone D., Ghanta S., Mehrara B.J. Definition, Incidence and Pathophysiology of Lymphedema // Principles and Practice of Lymphedema Surgery. Elsevier, 2016. P. 40–50.
- Michelini S., Campisi C., Failla A., Boccarda F., Moneta G. Staging of Lymphoedema: comparing different proposals // The European Journal of Lymphology. 2006. Vol. 16, № 46. P. 7–10.
- Fife C.E., Farrow W., Hebert A.A., Armer N.C., Stewart B.R., Cormier J.N., Armer J.M. Skin and Wound Care in Lymphedema Patients: A Taxonomy, Primer, and Literature Review // Adv Skin Wound Care. 2017. Vol. 30, № 7. P. 305–318.
- Olszewski W.L., Zagozda M., Zaleska M.T., Durlik M. Predilection to Dermato-Lymphangio-Adenitis in Obstructive Lymphedema of Lower Limbs Depending on Genetic Polymorphisms at TNFα-308G>A, CCR2-190G>A, CD14-159C>T, TLR2 2029C>T, TLR4 1063A>G, TLR4 1363C>T, TGFβ 74G>C, and TGFβ 29T>C // Lymphat Res Biol. 2018. Vol. 16, № 1. P. 109–116.
- Bisno A.L., Stevens D.L. Streptococcal infections of skin and soft tissues // N Engl J Med. 1996. Vol. 334, № 4. P. 240–245.
- Brishkoska-Boshkovski V., Kondova-Topuzovska I., Damevska K., Petrov A. Comorbidities as Risk Factors for Acute and Recurrent Erysipelas // Open Access Maced J Med Sci. 2019. Vol. 7, № 6. P. 937–942.
- Swartz M.N. Clinical practice. Cellulitis // N Engl J Med. 2004. Vol. 350, № 9. P. 904–912.
- Инфекционные болезни: национальное руководство / ed. Ющук Н.Д., Венгеров Ю.Я. ГЭОТАР-Медиа, 2009. 1040 p.
- Фейсханов А.К., Фатыхова Э.З., Фейсханова Л.И., Максимов А.В. Рожа и лимфедема // Практическая медицина. 2016. Vol. 4. P. 96.
- Devillers C., Vanhooteghem O., de la Brassinne M. [Lymphedema and cutaneous diseases] // Rev Med Suisse. 2007. Vol. 3, № 136. P. 2802–2805.
- Stevens D.L., Bisno A.L., Chambers H.F., Dellinger E.P., Goldstein E.J.C., Gorbach S.L., Hirschmann J. V, Kaplan S.L., Montoya J.G., Wade J.C., Infectious Diseases Society of America. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America // Clin Infect Dis. 2014. Vol. 59, № 2. P. e10-52.
- Raff A.B., Kroshinsky D. Cellulitis: A Review // JAMA. 2016. Vol. 316, № 3. P. 325–337.
- Dalal A., Eskin-Schwartz M., Mimouni D., Ray S., Days W., Hodak E., Leibovici L., Paul M. Interventions for the prevention of recurrent erysipelas and cellulitis // Cochrane Database Syst Rev. 2017. Vol. 6, № 6. P. CD009758.
- Bläckberg A., Trell K., Rasmussen M. Erysipelas, a large retrospective study of aetiology and clinical presentation // BMC Infect Dis. 2015. Vol. 15. P. 402.
- Bruun T., Oppegaard O., Kittang B.R., Mylvaganam H., Langeland N., Skrede S. Etiology of Cellulitis and Clinical Prediction of Streptococcal Disease: A Prospective Study // Open Forum Infect Dis. 2016. Vol. 3, № 1. P. ofv181.
- Gunderson C.G., Martinello R.A. A systematic review of bacteremias in cellulitis and erysipelas // J Infect. 2012. Vol. 64, № 2. P. 148–155.
- Rodriguez J.R., Hsieh F., Huang C.-T., Tsai T.-J., Chen C., Cheng M.-H. Clinical features, microbiological epidemiology and recommendations for management of cellulitis in extremity lymphedema // J Surg Oncol. 2020. Vol. 121, № 1. P. 25–36.
- Baddour L.M., Bisno A.L. Non-group A beta-hemolytic streptococcal cellulitis. Association with venous and lymphatic compromise // Am J Med. 1985. Vol. 79, № 2. P. 155–159.
- Baird J.B., Charles J.L., Streit T.G., Roberts J.M., Addiss D.G., Lammie P.J. Reactivity to bacterial, fungal, and parasite antigens in patients with lymphedema and elephantiasis // Am J Trop Med Hyg. 2002. Vol. 66, № 2. P. 163–169.
- Park S.I., Yang E.J., Kim D.K., Jeong H.J., Kim G.C., Sim Y.-J. Prevalence and Epidemiological Factors Involved in Cellulitis in Korean Patients With Lymphedema // Ann Rehabil Med. 2016. Vol. 40, № 2. P. 326–333.
- Cox N.H. Management of lower leg cellulitis // Clin Med (Lond). 2002. Vol. 2, № 1. P. 23–27.
- Dupuy A., Benchikhi H., Roujeau J.C., Bernard P., Vaillant L., Chosidow O., Sassolas B., Guillaume J.C., Grob J.J., Bastuji-Garin S. Risk factors for erysipelas of the leg (cellulitis): case-control study // BMJ. 1999. Vol. 318, № 7198. P. 1591–1594.
- Shenoy R.K. Clinical and pathological aspects of filarial lymphedema and its management // Korean J Parasitol. 2008. Vol. 46, № 3. P. 119–125.
- Hara H., Mihara M., Todokoro T. Necrotizing Fasciitis Occurred in the Lymphedematous leg // Int J Low Extrem Wounds. 2023. Vol. 22, № 3. P. 599–604.
- Kiaer T., Larsen J. Necrotizing fasciitis in congenital lymphedema. Case report // Acta Chir Scand. 1988. Vol. 154, № 11–12. P. 665–666.
- Jun Y.J., Kang I.S., Lee J.H., Kim S.M., Kim Y.J. A case of fatal necrotizing fasciitis arising from chronic lymphedema // Int J Low Extrem Wounds. 2013. Vol. 12, № 4. P. 293–296.
- Kim P.J., Mufti A., Sachdeva M., Lytvyn Y., Zabihi-Pour D., Zaaroura H., Yeung J. Stewart-Treves syndrome and other cutaneous malignancies in the context of chronic lymphedema: a systematic review // Int J Dermatol. 2022. Vol. 61, № 1. P. 62–70.
- Agbenorku P. Lymphedema: Complications and Management // Surg Sci. 2014. Vol. 05, № 07. P. 290–298.
- Styring E., Fernebro J., Jönsson P.-E., Ehinger A., Engellau J., Rissler P., Rydholm A., Nilbert M., Vult von Steyern F. Changing clinical presentation of angiosarcomas after breast cancer: from late tumors in edematous arms to earlier tumors on the thoracic wall // Breast Cancer Res Treat. 2010. Vol. 122, № 3. P. 883–887.
- Fury M.G., Antonescu C.R., Van Zee K.J., Brennan M.F., Maki R.G. A 14-year retrospective review of angiosarcoma: clinical characteristics, prognostic factors, and treatment outcomes with surgery and chemotherapy // Cancer J. 2005. Vol. 11, № 3. P. 241–247.
- da Costa Vieira R.A., de Araujo Silva I., de Oliveira-Junior I., de Almeida Santos Yamashita M.E., da Silva S.R.M. Unsuspected Stewart-Treves syndrome clinically mimicked by apparent bullous erysipelas and a systematic review of dermatological presentations of the classical Stewart-Treves syndrome // Cancer Rep (Hoboken). 2019. Vol. 2, № 2. P. e1143.
- Janssens P., Dekeuleneer V., Van Damme A., Brouillard P., Revencu N., Clapuyt P., Ferreira I., Ballieux F., Vikkula M., Marot L., Baeck M., Boon L.M. Angiosarcoma arising from congenital primary lymphedema // Pediatr Dermatol. 2018. Vol. 35, № 6. P. e382–e388.
- Yamada S., Yamada Y., Kobayashi M., Hino R., Nawata A., Noguchi H., Nakamura M., Nakayama T. Post-mastectomy benign lymphangioendothelioma of the skin following chronic lymphedema for breast carcinoma: a teaching case mimicking low-grade angiosarcoma and masquerading as Stewart-Treves syndrome // Diagn Pathol. 2014. Vol. 9. P. 197.
- Kayıran O., De La Cruz C., Tane K., Soran A. Lymphedema: From diagnosis to treatment // Turk J Surg. 2017. Vol. 33, № 2. P. 51–57.
- Grada A.A., Phillips T.J. Lymphedema: Pathophysiology and clinical manifestations // J Am Acad Dermatol. 2017. Vol. 77, № 6. P. 1009–1020.
- Paskett E.D., Dean J.A., Oliveri J.M., Harrop J.P. Cancer-related lymphedema risk factors, diagnosis, treatment, and impact: a review // J Clin Oncol. 2012. Vol. 30, № 30. P. 3726–3733.
- Damstra R.J., Halk A.-B., Dutch Working Group on Lymphedema. The Dutch lymphedema guidelines based on the International Classification of Functioning, Disability, and Health and the chronic care model // J Vasc Surg Venous Lymphat Disord . 2017. Vol. 5, № 5. P. 756–765.
- Levenhagen K., Davies C., Perdomo M., Ryans K., Gilchrist L. Diagnosis of Upper Quadrant Lymphedema Secondary to Cancer: Clinical Practice Guideline From the Oncology Section of the American Physical Therapy Association // Phys Ther. 2017. Vol. 97, № 7. P. 729–745.
- Stemmer R. [A clinical symptom for the early and differential diagnosis of lymphedema] // Vasa. 1976. Vol. 5, № 3. P. 261–262.
- Brauer W.J. Stemmer Sign Needs to be Recorded and Interpreted Correctly // Dtsch Arztebl Int. 2021. Vol. 118, № 3. P. 39.
- Kolluri R., Belangee Webb K.N. Massive buffalo hump: a case of stage III lymphedema // Circulation. 2011. Vol. 123, № 15. P. e408-9.
- Lymphedema. A Concise Compendium of Theory and Practice. / ed. Lee B.-B., Bergan J., Rockson S.G. London: Springer London, 2011.
- Выренков Ю.Е., Макарова В.С., Епанчинцева А.В., Макаров И.Г. Лимфедема // Вестник лимфологии. 2011. Vol. 4. P. 4–33.
- Felmerer G., Ernst J., Stepniewski A., Aung T. Classification and therapy of square toes in patients with chronic lymphedema // LymphForsch. 2014. Vol. 8, № 2. P. 60–65.
- Best Practice Guidelines: The Management of Lipoedema / ed. the Expert Working Group. Wounds UK, 2017.
- Jayaraj A., Raju S., May C., Pace N. The diagnostic unreliability of classic physical signs of lymphedema // J Vasc Surg Venous Lymphat Disord. 2019. Vol. 7, № 6. P. 890–897.
- Lymphedema. Presentation, Diagnosis, and Treatment. / ed. Greene A.K., Slavin S.A., Brorson H. Cham: Springer Cham, 2015.
- Myshencev P.N., Sushkov S.A., Katorkin S.E., Demidov S.I. Diagnostics of Lower Limbs Lymphedema // Flebologiia. 2017. Vol. 11, № 4. P. 228–237.
- Lymphedema / ed. Greene A.K., Slavin S.A., Brorson H. Cham: Springer International Publishing, 2015.
- Casley-Smith J.R. Measuring and representing peripheral oedema and its alterations // Lymphology. 1994. Vol. 27, № 2. P. 56–70.
- Boland R., Adams R. Development and evaluation of a precision forearm and hand volumeter and measuring cylinder // J Hand Ther. 1996. Vol. 9, № 4. P. 349–358.
- Morgan P.A., Moffat C.J. International consensus on managing lymphoedema // Nurs Times. 2006. Vol. 102, № 44. P. 42, 44.
- Deltombe T., Jamart J., Recloux S., Legrand C., Vandenbroeck N., Theys S., Hanson P. Reliability and limits of agreement of circumferential, water displacement, and optoelectronic volumetry in the measurement of upper limb lymphedema // Lymphology. 2007. Vol. 40, № 1. P. 26–34.
- Karges J.R., Mark B.E., Stikeleather S.J., Worrell T.W. Concurrent validity of upper-extremity volume estimates: comparison of calculated volume derived from girth measurements and water displacement volume // Phys Ther. 2003. Vol. 83, № 2. P. 134–145.
- Labs K.H., Tschoepl M., Gamba G., Aschwanden M., Jaeger K.A. The reliability of leg circumference assessment: a comparison of spring tape measurements and optoelectronic volumetry // Vasc Med. 2000. Vol. 5, № 2. P. 69–74.
- Moseley A., Piller N., Carati C. Combined opto-electronic perometry and bioimpedance to measure objectively the effectiveness of a new treatment intervention for chronic secondary leg lymphedema // Lymphology. 2002. Vol. 35, № 4. P. 136–143.
- Adriaenssens N., Buyl R., Lievens P., Fontaine C., Lamote J. Comparative study between mobile infrared optoelectronic volumetry with a Perometer and two commonly used methods for the evaluation of arm volume in patients with breast cancer related lymphedema of the arm // Lymphology. 2013. Vol. 46, № 3. P. 132–143.
- Brorson H., Höijer P. Standardised measurements used to order compression garments can be used to calculate arm volumes to evaluate lymphoedema treatment // J Plast Surg Hand Surg. 2012. Vol. 46, № 6. P. 410–415.
- Бородин Ю.И., Любарский М.С., Морозов В.В. Руководство по клинической лимфологии / ed. Бородин Ю.И., Любарский М.С., Морозов В.В. Москва: МИА, 2010.
- McLaughlin S.A., Staley A.C., Vicini F., Thiruchelvam P., Hutchison N.A., Mendez J., MacNeill F., Rockson S.G., DeSnyder S.M., Klimberg S., Alatriste M., Boccardo F., Smith M.L., Feldman S.M. Considerations for Clinicians in the Diagnosis, Prevention, and Treatment of Breast Cancer-Related Lymphedema: Recommendations from a Multidisciplinary Expert ASBrS Panel : Part 1: Definitions, Assessments, Education, and Future Directions // Ann Surg Oncol. 2017. Vol. 24, № 10. P. 2818–2826.
- Fife C.E., Carter M.J. Lymphedema in the morbidly obese patient: unique challenges in a unique population // Ostomy Wound Manage. 2008. Vol. 54, № 1. P. 44–56.
- Lepri F.R., Scavelli R., Digilio M.C., Gnazzo M., Grotta S., Dentici M.L., Pisaneschi E., Sirleto P., Capolino R., Baban A., Russo S., Franchin T., Angioni A., Dallapiccola B. Diagnosis of Noonan syndrome and related disorders using target next generation sequencing // BMC Med. Genet. 2014. Vol. 15, № 1. P. 14.
- Орлова А.А., Дадали Е.Л., Поляков А.В. Клинико-генетические характеристики синдрома Нунан и нунан-подобных заболеваний // Генетика. 2020. Vol. 56, № 5. P. 525–533.
- Visser J., van Geel M., Cornelissen A.J.M., van der Hulst R.R.W.J., Qiu S.S. Breast Cancer-Related Lymphedema and Genetic Predisposition: A Systematic Review of the Literature // Lymphat Res Biol. 2019. Vol. 17, № 3. P. 288–293.
- Sleutjes J., Kleimeier L., Leenders E., Klein W., Draaisma J. Lymphatic Abnormalities in Noonan Syndrome Spectrum Disorders: A Systematic Review // Mol Syndromol. 2022. Vol. 13, № 1. P. 1–11.
- Munn L.L., Padera T.P. Imaging the lymphatic system // Microvasc Res. 2014. Vol. 96. P. 55–63.
- Cariati A. Investigation of the Leg Lymphatic Function in Patients with Leg Acute Venous Thrombosis and in Patients with Leg Post-Thrombotic Syndrome // Open Circ Vasc J. 2012. Vol. 3, № 1. P. 67–71.
- Partsch H., Stöberl C., Urbanek A., Wenzel-Hora B.I. Clinical use of indirect lymphography in different forms of leg edema // Lymphology. 1988. Vol. 21, № 3. P. 152–160.
- Aström K.G., Abdsaleh S., Brenning G.C., Ahlström K.H. MR imaging of primary, secondary, and mixed forms of lymphedema // Acta Radiol. 2001. Vol. 42, № 4. P. 409–416.
- Rasmussen J.C., Aldrich M.B., Tan I.-C., Darne C., Zhu B., O’Donnell T.F., Fife C.E., Sevick-Muraca E.M. Lymphatic transport in patients with chronic venous insufficiency and venous leg ulcers following sequential pneumatic compression // J Vasc Surg Venous Lymphat Disord. 2016. Vol. 4, № 1. P. 9–17.
- Quartuccio N., Agugliaro F., Alongi P., Sturiale L., Arnone G., Corrao S. A Systematic Review Comparing Lymphoscintigraphy and Magnetic Resonance Imaging Techniques in the Assessment of Peripheral Lymphedema // Curr Med Imaging. 2022. Vol. 19, № 5. P. 469–475.
- Fearn N.R., Dylke E.S., Bailey D., Kilbreath S.L. Lymphoscintigraphy as an Outcome Measurement for Conservative Upper Limb Lymphedema Treatments: A Systematic Review // Lymphat Res Biol. 2022. Vol. 20, № 3. P. 248–259.
- van Heumen S., Riksen J.J.M., Bramer W.M., van Soest G., Vasilic D. Imaging of the Lymphatic Vessels for Surgical Planning: A Systematic Review // Ann Surg Oncol. 2023. Vol. 30, № 1. P. 462–479.
- Любарский М.С., Морозов В.В., Летягин А.Ю., Хапаев Р.С. Диагностика анатомо-функциональных нарушений в лимфатической системе // Лимфология / ed. Коненков В.И., Бородин Ю.И., Любарский М.С. Филиал “Гео” Издательства СО РАН, Издательский дом “Манускрипт,” 2012. P. 709–744.
- Steele J.E., Woodcock I.R., Murphy A.D., Ryan M.M., Penington T.J., Coombs C.J. Investigation of the activation of the temporalis and masseter muscles in voluntary and spontaneous smile production // J Plast Reconstr Aesthet Surg. 2018. Vol. 71, № 7. P. 1051–1057.
- Mihara M., Hara H., Kawakami Y. Ultrasonography for classifying lymphatic sclerosis types and deciding optimal sites for lymphatic-venous anastomosis in patients with lymphoedema<sup/> // J Plast Reconstr Aesthet Surg. 2018. Vol. 71, № 9. P. 1274–1281.
- Czedik-Eysenberg M., Steinbacher J., Obermayer B., Yoshimatsu H., Hara H., Mihara M., Tzou C.-H.J., Meng S. Exclusive use of ultrasound for locating optimal LVA sites-A descriptive data analysis // J Surg Oncol. 2020. Vol. 121, № 1. P. 51–56.
- Polomska A.K., Proulx S.T. Imaging technology of the lymphatic system // Adv Drug Deliv Rev. 2021. Vol. 170. P. 294–311.
- Rockson S.G. A Role for Near Infrared Fluorescent Imaging in the Evaluation of Lymphatic Function // Lymphat Res Biol. 2017. Vol. 15, № 3. P. 203.
- Unno N., Inuzuka K., Suzuki M., Yamamoto N., Sagara D., Nishiyama M., Konno H. Preliminary experience with a novel fluorescence lymphography using indocyanine green in patients with secondary lymphedema // J Vasc Surg. 2007. Vol. 45, № 5. P. 1016–1021.
- Granoff M.D., Johnson A.R., Lee B.T., Padera T.P., Bouta E.M., Singhal D. A Novel Approach to Quantifying Lymphatic Contractility during Indocyanine Green Lymphangiography // Plast Reconstr Surg. 2019. Vol. 144, № 5. P. 1197–1201.
- Narushima M., Yamamoto T., Ogata F., Yoshimatsu H., Mihara M., Koshima I. Indocyanine Green Lymphography Findings in Limb Lymphedema // J Reconstr Microsurg. 2016. Vol. 32, № 1. P. 72–79.
- O’Donnell T.F., Rasmussen J.C., Sevick-Muraca E.M. New diagnostic modalities in the evaluation of lymphedema // J Vasc Surg Venous Lymphat Disord. 2017. Vol. 5, № 2. P. 261–273.
- Gashev A.A., Nagai T., Bridenbaugh E.A. Indocyanine green and lymphatic imaging: current problems // Lymphat Res Biol. 2010. Vol. 8, № 2. P. 127–130.
- Mihara M., Murai N., Hayashi Y., Hara H., Iida T., Narushima M., Todokoro T., Uchida G., Yamamoto T., Koshima I. Using indocyanine green fluorescent lymphography and lymphatic-venous anastomosis for cancer-related lymphedema // Ann Vasc Surg. 2012. Vol. 26, № 2. P. 278.e1-6.
- Akita S., Mitsukawa N., Kazama T., Kuriyama M., Kubota Y., Omori N., Koizumi T., Kosaka K., Uno T., Satoh K. Comparison of lymphoscintigraphy and indocyanine green lymphography for the diagnosis of extremity lymphoedema // J Plast Reconstr Aesthet Surg. 2013. Vol. 66, № 6. P. 792–798.
- Toliyat M., Singh K., Sibley R.C., Chamarthy M., Kalva S.P., Pillai A.K. Interventional radiology in the management of thoracic duct injuries: Anatomy, techniques and results // Clin Imaging. 2017. Vol. 42. P. 183–192.
- Gruber-Rouh T., Naguib N.N.N., Lehnert T., Harth M., Thalhammer A., Beeres M., Tsaur I., Hammersting R., Wichmann J.L., Vogl T.J., Jacobi V. Direct lymphangiography as treatment option of lymphatic leakage: indications, outcomes and role in patient’s management // Eur J Radiol. 2014. Vol. 83, № 12. P. 2167–2171.
- Pieper C.C., Hur S., Sommer C.-M., Nadolski G., Maleux G., Kim J., Itkin M. Back to the Future: Lipiodol in Lymphography-From Diagnostics to Theranostics // Invest Radiol. 2019. Vol. 54, № 9. P. 600–615.
- Newman A.L., Rosenthall L., Towers A., Hodgson P., Shay C.A., Tidhar D., Vigano A., Kilgour R.D. Determining the precision of dual energy x-ray absorptiometry and bioelectric impedance spectroscopy in the assessment of breast cancer-related lymphedema // Lymphat Res Biol. 2013. Vol. 11, № 2. P. 104–109.
- Gjorup C., Zerahn B., Hendel H.W. Assessment of volume measurement of breast cancer-related lymphedema by three methods: circumference measurement, water displacement, and dual energy X-ray absorptiometry // Lymphat Res Biol. 2010. Vol. 8, № 2. P. 111–119.
- Hassanein A.H., Maclellan R.A., Grant F.D., Greene A.K. Diagnostic Accuracy of Lymphoscintigraphy for Lymphedema and Analysis of False-Negative Tests // Plast Reconstr Surg Glob Open. 2017. Vol. 5, № 7. P. e1396.
- Pappalardo M., Cheng M.-H. Lymphoscintigraphy for the diagnosis of extremity lymphedema: Current controversies regarding protocol, interpretation, and clinical application // J Surg Oncol. 2020. Vol. 121, № 1. P. 37–47.
- Modi S., Stanton A.W.B., Mortimer P.S., Levick J.R. Clinical assessment of human lymph flow using removal rate constants of interstitial macromolecules: a critical review of lymphoscintigraphy // Lymphat Res Biol. 2007. Vol. 5, № 3. P. 183–202.
- Yoo J.-N., Cheong Y.-S., Min Y.-S., Lee S.-W., Park H.Y., Jung T.-D. Validity of Quantitative Lymphoscintigraphy as a Lymphedema Assessment Tool for Patients With Breast Cancer // Ann Rehabil Med. 2015. Vol. 39, № 6. P. 931–940.
- Cintolesi V., Stanton A.W.B., Bains S.K., Cousins E., Peters A.M., Purushotham A.D., Levick J.R., Mortimer P.S. Constitutively Enhanced Lymphatic Pumping in the Upper Limbs of Women Who Later Develop Breast Cancer-Related Lymphedema // Lymphat Res Biol. 2016. Vol. 14, № 2. P. 50–61.
- Yang S., Bao W., Bai X., Gao C., Zhang B., Jiang Z. 99mTc-labeled sodium phytate and stannous chloride injection accurately detects sentinel lymph node in axillary of early stage breast cancer: a randomized, controlled study // Onco Targets Ther. 2018. Vol. 11. P. 1891–1898.
- O’Mahony S., Solanki C.K., Barber R.W., Mortimer P.S., Purushotham A.D., Peters A.M. Imaging of lymphatic vessels in breast cancer-related lymphedema: intradermal versus subcutaneous injection of 99mTc-immunoglobulin // AJR Am J Roentgenol. 2006. Vol. 186, № 5. P. 1349–1355.
- Wei L., Chen F., Zhang X., Li D., Yao Z., Deng L., Xiao G. 99mTc-dextran lymphoscintigraphy can detect sentinel lymph node in breast cancer patients // Exp Ther Med. 2015. Vol. 9, № 1. P. 112–116.
- Murphy B.L., Woodwick A.R., Murphy K.M., Chandler K.J., Johnson G.B., Hunt C.H., Peller P., Jakub J.W., Homb A.C. 99mTc-Tilmanocept Versus 99mTc-Sulfur Colloid in Lymphoscintigraphy: Sentinel Lymph Node Identification and Patient-Reported Pain // J Nucl Med Technol. 2019. Vol. 47, № 4. P. 300–304.
- Zhang J.-J., Zhang W.-C., An C.-X., Li X.-M., Ma L. Comparative research on 99mTc-Rituximab and 99mTc-sulfur colloid in sentinel lymph node imaging of breast cancer // BMC Cancer. 2019. Vol. 19, № 1. P. 956.
- Li J., Zhuang Z., Jiang B., Zhao P., Lin C. Advances and perspectives in nanoprobes for noninvasive lymph node mapping // Nanomedicine (Lond). 2015. Vol. 10, № 6. P. 1019–1036.
- Zbyszynski P., Toraason I., Repp L., Kwon G.S. Probing the subcutaneous absorption of a PEGylated FUD peptide nanomedicine via in vivo fluorescence imaging // Nano Converg. 2019. Vol. 6, № 1. P. 22.
- Iimura T., Fukushima Y., Kumita S., Ogawa R., Hyakusoku H. Estimating Lymphodynamic Conditions and Lymphovenous Anastomosis Efficacy Using (99m)Tc-phytate Lymphoscintigraphy with SPECT-CT in Patients with Lower-limb Lymphedema // Plast Reconstr Surg Glob Open. 2015. Vol. 3, № 5. P. e404.
- Meher B.R., Agrawal K., Gnanasegaran G. Review of Adverse Reactions Associated with the Use of Common Diagnostic Radiopharmaceuticals // Indian J Nucl Med. 2021. Vol. 36, № 2. P. 163–167.
- Mills M., van Zanten M., Borri M., Mortimer P.S., Gordon K., Ostergaard P., Howe F.A. Systematic Review of Magnetic Resonance Lymphangiography From a Technical Perspective // J Magn Reson Imaging. 2021. Vol. 53, № 6. P. 1766–1790.
- Lu Q., Xu J., Liu N. Chronic lower extremity lymphedema: a comparative study of high-resolution interstitial MR lymphangiography and heavily T2-weighted MRI // Eur J Radiol. 2010. Vol. 73, № 2. P. 365–373.
- Shinaoka A., Koshimune S., Yamada K., Kumagishi K., Suami H., Kimata Y., Ohtsuka A. Correlations between Tracer Injection Sites and Lymphatic Pathways in the Leg: A Near-Infrared Fluorescence Lymphography Study // Plast Reconstr Surg. 2019. Vol. 144, № 3. P. 634–642.
- Arrivé L., Derhy S., Dahan B., El Mouhadi S., Monnier-Cholley L., Menu Y., Becker C. Primary lower limb lymphoedema: classification with non-contrast MR lymphography // Eur Radiol. 2018. Vol. 28, № 1. P. 291–300.
- Yoshimatsu H., Yamamoto T., Tanakura K., Fuse Y., Hayashi A. Noncontrast Magnetic Resonance Lymphography for Evaluation of Lymph Node Transfer for Secondary Upper Limb Lymphedema // Plast Reconstr Surg. 2018. Vol. 142, № 4. P. 601e–603e.
- Arrivé L., Derhy S., El Mouhadi S., Monnier-Cholley L., Menu Y., Becker C. Noncontrast Magnetic Resonance Lymphography // J Reconstr Microsurg. 2016. Vol. 32, № 1. P. 80–86.
- Lohrmann C., Foeldi E., Bartholomä J.-P., Langer M. Magnetic resonance imaging of lymphatic vessels without image subtraction: a practicable imaging method for routine clinical practice? // J Comput Assist Tomogr. 2007. Vol. 31, № 2. P. 303–308.
- Rane S., Donahue P.M.C., Towse T., Ridner S., Chappell M., Jordi J., Gore J., Donahue M.J. Clinical feasibility of noninvasive visualization of lymphatic flow with principles of spin labeling MR imaging: implications for lymphedema assessment // Radiology. 2013. Vol. 269, № 3. P. 893–902.
- Crescenzi R., Donahue P.M.C., Mahany H., Lants S.K., Donahue M.J. CEST MRI quantification procedures for breast cancer treatment-related lymphedema therapy evaluation // Magn Reson Med. 2020. Vol. 83, № 5. P. 1760–1773.
- Donahue M.J., Donahue P.C.M., Rane S., Thompson C.R., Strother M.K., Scott A.O., Smith S.A. Assessment of lymphatic impairment and interstitial protein accumulation in patients with breast cancer treatment-related lymphedema using CEST MRI // Magn Reson Med. 2016. Vol. 75, № 1. P. 345–355.
- Летягин А.Ю., Летягина Е.А. МРТ-анализ патологических изменений лимфатической системы (Глава 5.3) // Лимфология / ed. Коненков В.И., Бородин Ю.И., Любарский М.С. Новосибирск: Изд.дом «Манускрипт», 2012. P. 362–411.
- Летягин А.Ю. Инструментальные методы исследования крово- и лимфообращения (Глава 5.2) // Лимфология / ed. Коненков В.И., Бородин Ю.И., Любарский М.С. Новосибирск: Изд.дом «Манускрипт», 2012. P. 344–361.
- Yoshimura G., Sakurai T., Oura S., Suzuma T., Tamaki T., Umemura T., Kokawa Y., Yang Q. Evaluation of Axillary Lymph Node Status in Breast Cancer with MRI // Breast Cancer. 1999. Vol. 6, № 3. P. 249–258.
- Weiss M., Burgard C., Baumeister R., Strobl F., Rominger A., Bartenstein P., Wallmichrath J., Frick A., Notohamiprodjo M. Magnetic resonance imaging versus lymphoscintigraphy for the assessment of focal lymphatic transport disorders of the lower limb: first experiences // Nuklearmedizin. 2014. Vol. 53, № 5. P. 190–196.
- Mazzei M.A., Gentili F., Mazzei F.G., Gennaro P., Guerrieri D., Nigri A., Gabriele G., Weber E., Fausto A., Botta G., Volterrani L. High-resolution MR lymphangiography for planning lymphaticovenous anastomosis treatment: a single-centre experience // Radiol Med. 2017. Vol. 122, № 12. P. 918–927.
- Lohrmann C., Foeldi E., Bartholomae J.-P., Langer M. Gadoteridol for MR imaging of lymphatic vessels in lymphoedematous patients: initial experience after intracutaneous injection // Br J Radiol. 2007. Vol. 80, № 955. P. 569–573.
- Borri M., Schmidt M.A., Gordon K.D., Wallace T.A., Hughes J.C., Scurr E.D., Koh D.-M., Leach M.O., Mortimer P.S. Quantitative Contrast-Enhanced Magnetic Resonance Lymphangiography of the Upper Limbs in Breast Cancer Related Lymphedema: An Exploratory Study // Lymphat Res Biol. 2015. Vol. 13, № 2. P. 100–106.
- Mitsumori L.M., McDonald E.S., Neligan P.C., Maki J.H. Peripheral Magnetic Resonance Lymphangiography: Techniques and Applications // Tech Vasc Interv Radiol. 2016. Vol. 19, № 4. P. 262–272.
- Mitsumori L.M., McDonald E.S., Wilson G.J., Neligan P.C., Minoshima S., Maki J.H. MR lymphangiography: How i do it // J Magn Reson Imaging. 2015. Vol. 42, № 6. P. 1465–1477.
- Forte A.J., Huayllani M.T., Boczar D., Ciudad P., Lu X., Kassis S., Parker A.S., Moore P.A., McLaughlin S.A. Bioimpedance Spectroscopy for Assessment of Breast Cancer-Related Lymphedema: A Systematic Review // Plast Surg Nurs. 2020. Vol. 40, № 2. P. 86–90.
- Ohberg F., Zachrisson A., Holmner-Rocklöv Å. Three-dimensional camera system for measuring arm volume in women with lymphedema following breast cancer treatment // Lymphat Res Biol. 2014. Vol. 12, № 4. P. 267–274.
- Lu G., DeSouza G.N., Armer J., Anderson B., Shyu C.-R. A system for limb-volume measurement using 3D models from an infrared depth sensor // 2013 IEEE Symposium on Computational Intelligence in Healthcare and e-health (CICARE). IEEE, 2013. P. 64–69.
- Abassi Z., Khoury E.E., Karram T., Aronson D. Edema formation in congestive heart failure and the underlying mechanisms // Front Cardiovasc Med. 2022. Vol. 9. P. 933215.
- Frost A., Badesch D., Gibbs J.S.R., Gopalan D., Khanna D., Manes A., Oudiz R., Satoh T., Torres F., Torbicki A. Diagnosis of pulmonary hypertension // Eur Respir J. 2019. Vol. 53, № 1.
- Tacani P.M., Ribeiro D. de O., Barros Guimarães B.E., Machado A.F.P., Tacani R.E. Characterization of symptoms and edema distribution in premenstrual syndrome // Int J Womens Health. 2015. Vol. 7. P. 297–303.
- Whayne T.F., Fisher M.B. Idiopathic “Cyclic” Edema: A Frustrating and Poorly Understood Clinical Problem // Cardiovasc Hematol Agents Med Chem. 2018. Vol. 16, № 2. P. 88–93.
- Pereira de Godoy J.M., Pereira de Godoy H.J., Pereira de Godoy L.M., Guerreiro Godoy M. de F. Prevalence of Idiopathic Cyclic Edema in Women with Lower Limb Lymphedema // J Clin Med. 2017. Vol. 7, № 1.
- Largeau B., Cracowski J.-L., Lengellé C., Sautenet B., Jonville-Béra A.-P. Drug-induced peripheral oedema: An aetiology-based review // Br J Clin Pharmacol. 2021. Vol. 87, № 8. P. 3043–3055.
- Liang L., Kung J.Y., Mitchelmore B., Cave A., Banh H.L. Comparative peripheral edema for dihydropyridines calcium channel blockers treatment: A systematic review and network meta-analysis // J Clin Hypertens (Greenwich). 2022. Vol. 24, № 5. P. 536–554.
- Dyadyk A.I., Kugler T.E. Side effects of non-steroidal anti-inflammatory drugs // Consilium Medicum. 2017. Vol. 19, № 12. P. 94–99.
- Wei A., Gu Z., Li J., Liu X., Wu X., Han Y., Pu J. Clinical Adverse Effects of Endothelin Receptor Antagonists: Insights From the Meta-Analysis of 4894 Patients From 24 Randomized Double-Blind Placebo-Controlled Clinical Trials // J Am Heart Assoc. 2016. Vol. 5, № 11.
- Cohen M.M. Proteus syndrome: an update // Am J Med Genet C Semin Med Genet. 2005. Vol. 137C, № 1. P. 38–52.
- Torre Y.S.-D. la, Wadeea R., Rosas V., Herbst K.L. Lipedema: friend and foe // Horm Mol Biol Clin Investig. 2018. Vol. 33, № 1.
- Bertsch T., Erbacher G., Elwell R. Lipoedema: a paradigm shift and consensus // J Wound Care. 2020. Vol. 29, № Sup11b. P. 1–51.
- Child A.H., Gordon K.D., Sharpe P., Brice G., Ostergaard P., Jeffery S., Mortimer P.S. Lipedema: an inherited condition // Am J Med Genet A. 2010. Vol. 152A, № 4. P. 970–976.
- Cellina M., Gibelli D., Soresina M., Menozzi A., Martinenghi C., Panzeri M., Oliva G. Non-contrast MR Lymphography of lipedema of the lower extremities // Magn Reson Imaging. 2020. Vol. 71. P. 115–124.
- Warren Peled A., Kappos E.A. Lipedema: diagnostic and management challenges // Int J Womens Health. 2016. Vol. 8. P. 389–395.
- Cormier J.N., Rourke L., Crosby M., Chang D., Armer J. The surgical treatment of lymphedema: a systematic review of the contemporary literature (2004-2010) // Ann Surg Oncol. 2012. Vol. 19, № 2. P. 642–651.
- Carl H.M., Walia G., Bello R., Clarke-Pearson E., Hassanein A.H., Cho B., Pedreira R., Sacks J.M. Systematic Review of the Surgical Treatment of Extremity Lymphedema // J Reconstr Microsurg. 2017. Vol. 33, № 6. P. 412–425.
- Grada A.A., Phillips T.J. Lymphedema: Diagnostic workup and management // J Am Acad Dermatol. 2017. Vol. 77, № 6. P. 995–1006.
- Макарова В.С. Комплексная физическая противоотечная терапия в лечении лимфедем / ed. Макарова В.С., Выренков Ю.Е. АНО “Лимфа,” 2014. 120 p.
- Brandão M.L., Soares H.P.D.S., Andrade M. do A., Faria A.L.S. de C., Pires R.S. Efficacy of complex decongestive therapy for lymphedema of the lower limbs: a systematic review // J Vasc Bras. 2020. Vol. 19. P. e20190074.
- Hasenoehrl T., Keilani M., Palma S., Crevenna R. Resistance exercise and breast cancer related lymphedema - a systematic review update // Disabil Rehabil. 2020. Vol. 42, № 1. P. 26–35.
- Torgbenu E., Luckett T., Buhagiar M.A., Phillips J.L. Guidelines Relevant to Diagnosis, Assessment, and Management of Lymphedema: A Systematic Review // Adv Wound Care (New Rochelle). 2023. Vol. 12, № 1. P. 15–27.
- Fu M.R., Deng J., Armer J.M. Putting evidence into practice: cancer-related lymphedema // Clin J Oncol Nurs. 2014. Vol. 18 Suppl. P. 68–79.
- Vojáčková N., Fialová J., Hercogová J. Management of lymphedema // Dermatol Ther. 2012. Vol. 25, № 4. P. 352–357.
- Melam G.R., Buragadda S., Alhusaini A.A., Arora N. Effect of complete decongestive therapy and home program on health- related quality of life in post mastectomy lymphedema patients // BMC Womens Health. 2016. Vol. 16. P. 23.
- Ko D.S., Lerner R., Klose G., Cosimi A.B. Effective treatment of lymphedema of the extremities // Arch Surg. 1998. Vol. 133, № 4. P. 452–458.
- Thompson B., Gaitatzis K., Janse de Jonge X., Blackwell R., Koelmeyer L.A. Manual lymphatic drainage treatment for lymphedema: a systematic review of the literature // J Cancer Surviv. 2021. Vol. 15, № 2. P. 244–258.
- Szuba A., Cooke J.P., Yousuf S., Rockson S.G. Decongestive lymphatic therapy for patients with cancer-related or primary lymphedema // Am J Med. 2000. Vol. 109, № 4. P. 296–300.
- Lasinski B.B., McKillip Thrift K., Squire D., Austin M.K., Smith K.M., Wanchai A., Green J.M., Stewart B.R., Cormier J.N., Armer J.M. A systematic review of the evidence for complete decongestive therapy in the treatment of lymphedema from 2004 to 2011 // PM R. 2012. Vol. 4, № 8. P. 580–601.
- Bozkurt M., Palmer L.J., Guo Y. Effectiveness of Decongestive Lymphatic Therapy in Patients with Lymphedema Resulting from Breast Cancer Treatment Regardless of Previous Lymphedema Treatment // Breast J. 2017. Vol. 23, № 2. P. 154–158.
- Didem K., Ufuk Y.S., Serdar S., Zümre A. The comparison of two different physiotherapy methods in treatment of lymphedema after breast surgery // Breast Cancer Res Treat. 2005. Vol. 93, № 1. P. 49–54.
- Cohen S.R., Payne D.K., Tunkel R.S. Lymphedema: strategies for management // Cancer. 2001. Vol. 92, № 4 Suppl. P. 980–987.
- Borman P., Yaman A., Yasrebi S., Pınar İnanlı A., Arıkan Dönmez A. Combined Complete Decongestive Therapy Reduces Volume and Improves Quality of Life and Functional Status in Patients With Breast Cancer-Related Lymphedema // Clin Breast Cancer. 2022. Vol. 22, № 3. P. e270–e277.
- Atan T., Bahar-Özdemir Y. The Effects of Complete Decongestive Therapy or Intermittent Pneumatic Compression Therapy or Exercise Only in the Treatment of Severe Lipedema: A Randomized Controlled Trial // Lymphat Res Biol. 2021. Vol. 19, № 1. P. 86–95.
- Tzani I., Tsichlaki M., Zerva E., Papathanasiou G., Dimakakos E. Physiotherapeutic rehabilitation of lymphedema: state-of-the-art // Lymphology. 2018. Vol. 51, № 1. P. 1–12.
- Finnane A., Janda M., Hayes S.C. Review of the evidence of lymphedema treatment effect // Am J Phys Med Rehabil. 2015. Vol. 94, № 6. P. 483–498.
- Wang X., Ding Y., Cai H.-Y., You J., Fan F.-Q., Cai Z.-F., An P. Effectiveness of modified complex decongestive physiotherapy for preventing lower extremity lymphedema after radical surgery for cervical cancer: a randomized controlled trial // Int J Gynecol Cancer. 2020. Vol. 30, № 6. P. 757–763.
- Hamner J.B., Fleming M.D. Lymphedema therapy reduces the volume of edema and pain in patients with breast cancer // Ann Surg Oncol. 2007. Vol. 14, № 6. P. 1904–1908.
- Mondry T.E., Riffenburgh R.H., Johnstone P.A.S. Prospective trial of complete decongestive therapy for upper extremity lymphedema after breast cancer therapy // Cancer J. 2004. Vol. 10, № 1. P. 42–48; discussion 17-9.
- Warren A.G., Brorson H., Borud L.J., Slavin S.A. Lymphedema: a comprehensive review // Ann Plast Surg. 2007. Vol. 59, № 4. P. 464–472.
- Yeşil H., Eyigör S., İnbat M., Bulut F. The effects of complex decongestive therapy on kinesthetic sense of hands, upper extremity function, and quality of life in patients with breast cancer-related lymphedema // Turk J Phys Med Rehabil. 2021. Vol. 67, № 2. P. 211–217.
- Nakao F., Furutani A., Yoshimura K., Hamano K., Kinoshita Y., Kawamoto R., Nakao H., Suzuki S. [The outcomes of program based on complex decongestive physiotherapy for a patient with secondary lymphedema caused by infection on the leg] // Fukuoka Igaku Zasshi. 2009. Vol. 100, № 6. P. 235–241.
- Liu F., Liu N.-F., Wang L., Chen J., Han L., Yu Z., Sun D. Treatment of secondary lower limb lymphedema after gynecologic cancer with complex decongestive therapy // Lymphology. 2021. Vol. 54, № 3. P. 122–132.
- Vaillant L., Müller C., Goussé P. [Treatment of limbs lymphedema] // Presse Med. 2010. Vol. 39, № 12. P. 1315–1323.
- Karadibak D., Yavuzsen T., Saydam S. Prospective trial of intensive decongestive physiotherapy for upper extremity lymphedema // J Surg Oncol. 2008. Vol. 97, № 7. P. 572–577.
- Jäger G., Döller W., Roth R. Quality-of-life and body image impairments in patients with lymphedema // Lymphology. 2006. Vol. 39, № 4. P. 193–200.
- Kalemikerakis I., Evaggelakou A., Kavga A., Vastardi M., Konstantinidis T., Govina O. Diagnosis, treatment and quality of life in patients with cancer-related lymphedema // J BUON. 2021. Vol. 26, № 5. P. 1735–1741.
- Chima C., Murray B., Moore Z., Costello M., George S. Health-related quality of life and assessment in patients with lower limb lymphoedema: a systematic review // J Wound Care. 2022. Vol. 31, № 8. P. 690–699.
- Arrault M., Vignes S. [Management of lymphedema of the upper extremity after treatment of breast cancer] // Bull Cancer. 2007. Vol. 94, № 7. P. 669–674.
- Zasadzka E., Trzmiel T., Kleczewska M., Pawlaczyk M. Comparison of the effectiveness of complex decongestive therapy and compression bandaging as a method of treatment of lymphedema in the elderly // Clin Interv Aging. 2018. Vol. 13. P. 929–934.
- Földi E., Földi M. Complete Decongestive Therapy // Lymphedema. London: Springer London, 2011. P. 229–236.
- Partsch H., Stout N., Forner-Cordero I., Flour M., Moffatt C., Szuba A., Milic D., Szolnoky G., Brorson H., Abel M., Schuren J., Schingale F., Vignes S., Piller N., Döller W. Clinical trials needed to evaluate compression therapy in breast cancer related lymphedema (BCRL). Proposals from an expert group // Int Angiol. 2010. Vol. 29, № 5. P. 442–453.
- Макарова В.С., Макаров И.Г., Спиридонов В.К. Консервативное лечение лимфедем. Пособие для врачей / ed. Выренков Ю.Е. Москва: АНО “Лимфа,” 2011. 50 p.
- Randheer S., Kadambari D., Srinivasan K., Bhuvaneswari V., Bhanumathy M., Salaja R. Comprehensive decongestive therapy in postmastectomy lymphedema: an Indian perspective // Indian J Cancer. 2011. Vol. 48, № 4. P. 397–402.
- Strössenreuther R.H.K., Dax I., Emde C. [Lymphedema--treatment] // MMW Fortschr Med. 2004. Vol. 146, № 3–4. P. 28–30, 32–33.
- Doś J., Górska-Doś M., Szuba A. The integrated and interdisciplinary treatment of chronic lymphedema // Rocz Akad Med Bialymst. 2005. Vol. 50 Suppl 1. P. 141–144.
- Zhang H.-Z., Zhong Q.-L., Zhang H.-T., Luo Q.-H., Tang H.-L., Zhang L.-J. Effectiveness of six-step complex decongestive therapy for treating upper limb lymphedema after breast cancer surgery // World J Clin Cases. 2022. Vol. 10, № 25. P. 8827–8836.
- Lamprou D.-A.A., Damstra R.J., Partsch H. Prospective, randomized, controlled trial comparing a new two-component compression system with inelastic multicomponent compression bandages in the treatment of leg lymphedema // Dermatol Surg. 2011. Vol. 37, № 7. P. 985–991.
- Damstra R.J., Partsch H. Prospective, randomized, controlled trial comparing the effectiveness of adjustable compression Velcro wraps versus inelastic multicomponent compression bandages in the initial treatment of leg lymphedema // J Vasc Surg Venous Lymphat Disord. 2013. Vol. 1, № 1. P. 13–19.
- Vignes S., Porcher R., Arrault M., Dupuy A. Long-term management of breast cancer-related lymphedema after intensive decongestive physiotherapy // Breast Cancer Res Treat. 2007. Vol. 101, № 3. P. 285–290.
- McNeely M.L., Dolgoy N.D., Rafn B.S., Ghosh S., Ospina P.A., Al Onazi M.M., Radke L., Shular M., Kuusk U., Webster M., Campbell K.L., Mackey J.R. Nighttime compression supports improved self-management of breast cancer-related lymphedema: A multicenter randomized controlled trial // Cancer. 2022. Vol. 128, № 3. P. 587–596.
- Bock K.J., Ehmann J.S., Muldoon J. The 24-hour interval compression plan: part 2-lifestyle and therapeutic regimens to manage chronic oedema case series // J Wound Care. 2022. Vol. 31, № 3. P. 218–223.
- Chohan A., Sumner S., Olivier M., Whitaker J. Case study: night compression use in a patient with Milroy’s disease // Br J Nurs. 2022. Vol. 31, № 12. P. S34–S41.
- Sudduth C.L., Greene A.K. Lymphedema and Sports: A Case Series of Athletic Patients // Lymphat Res Biol. 2022. Vol. 20, № 5. P. 522–524.
- Cheifetz O., Haley L., Breast Cancer Action. Management of secondary lymphedema related to breast cancer // Can Fam Physician. 2010. Vol. 56, № 12. P. 1277–1284.
- Omar M.T.A., Gwada R.F.M., Omar G.S.M., El-Sabagh R.M., Mersal A.-E.A.E. Low-Intensity Resistance Training and Compression Garment in the Management of Breast Cancer-Related Lymphedema: Single-Blinded Randomized Controlled Trial // J Cancer Educ. 2020. Vol. 35, № 6. P. 1101–1110.
- Pinell X.A., Kirkpatrick S.H., Hawkins K., Mondry T.E., Johnstone P.A.S. Manipulative therapy of secondary lymphedema in the presence of locoregional tumors // Cancer. 2008. Vol. 112, № 4. P. 950–954.
- Földi M. Remarks concerning the consensus document (CD) of the International Society of Lymphology “The diagnosis and treatment of peripheral lymphedema” // Lymphology. 2004. Vol. 37, № 4. P. 168–173.
- Soucek-Hadwiger B., Döller W. [Secondary malignant lymphedema] // Wien Med Wochenschr. 2006. Vol. 156, № 9–10. P. 309–313.
- Godette K., Mondry T.E., Johnstone P.A.S. Can manual treatment of lymphedema promote metastasis? // J Soc Integr Oncol. 2006. Vol. 4, № 1. P. 8–12.
- Lin Y., Yang Y., Zhang X., Li W., Li H., Mu D. Manual Lymphatic Drainage for Breast Cancer-related Lymphedema: A Systematic Review and Meta-analysis of Randomized Controlled Trials // Clin Breast Cancer. 2022. Vol. 22, № 5. P. e664–e673.
- Qiao J., Yang L.-N., Kong Y.-H., Huang X., Li Y., Bai D.-Q. Effect of Manual Lymphatic Drainage on Breast Cancer-Related Postmastectomy Lymphedema: A Meta-analysis of Randomized Controlled Trials // Cancer Nurs. Vol. 46, № 2. P. 159–166.
- Ezzo J., Manheimer E., McNeely M.L., Howell D.M., Weiss R., Johansson K.I., Bao T., Bily L., Tuppo C.M., Williams A.F., Karadibak D. Manual lymphatic drainage for lymphedema following breast cancer treatment // Cochrane Database Syst Rev. 2015. № 5. P. CD003475.
- Liang M., Chen Q., Peng K., Deng L., He L., Hou Y., Zhang Y., Guo J., Mei Z., Li L. Manual lymphatic drainage for lymphedema in patients after breast cancer surgery: A systematic review and meta-analysis of randomized controlled trials // Medicine (Baltimore). 2020. Vol. 99, № 49. P. e23192.
- Wanchai A., Armer J.M. Manual Lymphedema Drainage for Reducing Risk for and Managing Breast Cancer-Related Lymphedema After Breast Surgery: A Systematic Review // Nurs Womens Health. 2021. Vol. 25, № 5. P. 377–383.
- Kaciulyte J., Garutti L., Spadoni D., Velazquez-Mujica J., Losco L., Ciudad P., Marcasciano M., Lo Torto F., Casella D., Ribuffo D., Chen H.-C. Genital Lymphedema and How to Deal with It: Pearls and Pitfalls from over 38 Years of Experience with Unusual Lymphatic System Impairment // Medicina (Kaunas). 2021. Vol. 57, № 11.
- Torio-Padron N., Stark G.B., Földi E., Simunovic F. Treatment of male genital lymphedema: an integrated concept // J Plast Reconstr Aesthet Surg. 2015. Vol. 68, № 2. P. 262–268.
- Smith B.G., Lewin J.S. Lymphedema management in head and neck cancer // Curr Opin Otolaryngol Head Neck Surg. 2010. Vol. 18, № 3. P. 153–158.
- Katz E.E., Lyon M.B., Davis D., Gottlieb L.J., Brendler C.B. Manual lymphatic drainage for the treatment of acute genital lymphedema // J Urol. 2004. Vol. 172, № 1. P. 157–158.
- Pinto e Silva M.P., Bassani M.A., Miquelutti M.A., Marques A. de A., do Amaral M.T.P., de Oliveira M.M.F., Ferreira N. de O. Manual lymphatic drainage and multilayer compression therapy for vulvar edema: a case series // Physiother Theory Pract. 2015. Vol. 31, № 7. P. 527–531.
- Kasseroller R.G. The Vodder School: the Vodder method // Cancer. 1998. Vol. 83, № 12 Suppl American. P. 2840–2842.
- Boiselle Howard S., Krishnagiri S. The use of manual edema mobilization for the reduction of persistent edema in the upper limb // J Hand Ther. 2001. Vol. 14, № 4. P. 291–301.
- Artzberger S. Edema Reduction Techniques: A Biologic Rationale for Selection. Chapter 3 // Fundamentals of Hand Therapy / ed. Cooper C. St. Louis: Mosby Elsevier, 2007. P. 36–52.
- Leduc O., Leduc A. Manual Lymph Drainage (Leduc Method) // Lymphedema / ed. Lee B., Bergan J., Rockson S. London: Springer, 2011. P. 245–249.
- Kafejian-Haddad A.P., Perez J.M.C., Castiglioni M.L. V, Miranda Júnior F., de Figueiredo L.F.P. Lymphscintigraphic evaluation of manual lymphatic drainage for lower extremity lymphedema // Lymphology. 2006. Vol. 39, № 1. P. 41–48.
- Bellhouse S. Simple lymphatic drainage // Lymphoedema / ed. Twycross R., Jenns K., Todd J. Oxford: Radcliffe Medical Press, 2000. P. 217–235.
- de Godoy J.M.P., Batigalia F., Godoy M. de F.G. Preliminary evaluation of a new, more simplified physiotherapy technique for lymphatic drainage // Lymphology. 2002. Vol. 35, № 2. P. 91–93.
- Министерство здравоохранения Российской Федерации. Приказ Министерства здравоохранения Российской Федерации от 07.07.2020 № 686н "О внесении изменений в приложения № 1 и № 2 к приказу Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н “Об утверждении номенклатурной классификации медицинских изделий” [Электронный ресурс]. 2020. URL: http://publication.pravo.gov.ru/Document/View/0001202008100015 (дата обращения:19.10.2023).
- Федеральная служба по надзору в сфере здравоохранения. Номенклатурная классификация медицинских изделий по видам [Электронный ресурс]. 2020. URL: https://www.roszdravnadzor.gov.ru/services/mi_reesetr (дата обращения:19.10.2023).
- Badger C., Preston N., Seers K., Mortimer P. Physical therapies for reducing and controlling lymphoedema of the limbs // Cochrane Database Syst Rev. 2004. № 4. P. CD003141.
- Li J.-X., Gao J., Song J.-Y., Li H.-P., Yang W.-J., Tong D.-T., Zou Y. Compression Therapy for the Patients With Breast Cancer: A Meta-analysis of Randomized Controlled Trials // Cancer Nurs. Vol. 45, № 4. P. E736–E745.
- Mosti G., Cavezzi A. Compression therapy in lymphedema: Between past and recent scientific data // Phlebology. 2019. Vol. 34, № 8. P. 515–522.
- Wright T., Scarfino C.D., O’Malley E.M. Effect of pneumatic compression device and stocking use on symptoms and quality of life in women with lipedema: A proof-in-principle randomized trial // Phlebology. 2023. Vol. 38, № 1. P. 51–61.
- Blom K.Y., Johansson K.I., Nilsson-Wikmar L.B., Brogårdh C.B. Early intervention with compression garments prevents progression in mild breast cancer-related arm lymphedema: a randomized controlled trial // Acta Oncol. 2022. Vol. 61, № 7. P. 897–905.
- McLaughlin S.A., DeSnyder S.M., Klimberg S., Alatriste M., Boccardo F., Smith M.L., Staley A.C., Thiruchelvam P.T.R., Hutchison N.A., Mendez J., MacNeill F., Vicini F., Rockson S.G., Feldman S.M. Considerations for Clinicians in the Diagnosis, Prevention, and Treatment of Breast Cancer-Related Lymphedema, Recommendations from an Expert Panel: Part 2: Preventive and Therapeutic Options // Ann Surg Oncol. 2017. Vol. 24, № 10. P. 2827–2835.
- Torres-Lacomba M., Navarro-Brazález B., Prieto-Gómez V., Ferrandez J.C., Bouchet J.Y., Romay-Barrero H. Effectiveness of four types of bandages and kinesio-tape for treating breast-cancer-related lymphoedema: a randomized, single-blind, clinical trial // Clin Rehabil. 2020. Vol. 34, № 9. P. 1230–1241.
- Dhar A., Srivastava A., Pandey R.M., Shrestha P., Villet S., Gogia A.R. Safety and Efficacy of a Mobiderm Compression Bandage During Intensive Phase of Decongestive Therapy in Patients with Breast Cancer-Related Lymphedema: A Randomized Controlled Trial // Lymphat Res Biol. 2023. Vol. 21, № 1. P. 52–59.
- Borman P., Koyuncu E.G., Yaman A., Calp E., Koç F., Sargut R., Karahan S. The Comparative Efficacy of Conventional Short-Stretch Multilayer Bandages and Velcro Adjustable Compression Wraps in Active Treatment Phase of Patients with Lower Limb Lymphedema // Lymphat Res Biol. 2021. Vol. 19, № 3. P. 286–294.
- Badger C.M., Peacock J.L., Mortimer P.S. A randomized, controlled, parallel-group clinical trial comparing multilayer bandaging followed by hosiery versus hosiery alone in the treatment of patients with lymphedema of the limb // Cancer. 2000. Vol. 88, № 12. P. 2832–2837.
- Partsch H. The use of pressure change on standing as a surrogate measure of the stiffness of a compression bandage // Eur J Vasc Endovasc Surg. 2005. Vol. 30, № 4. P. 415–421.
- Partsch H., Clark M., Bassez S., Benigni J.-P., Becker F., Blazek V., Caprini J., Cornu-Thénard A., Hafner J., Flour M., Jünger M., Moffatt C., Neumann M. Measurement of lower leg compression in vivo: recommendations for the performance of measurements of interface pressure and stiffness: consensus statement // Dermatol Surg. 2006. Vol. 32, № 2. P. 224–232; discussion 233.
- Moffatt C., Mortimer P., Partsch H. Lymphoedema bandaging in practice. European Wound Management Association (EWMA). Focus Document. / ed. Moffatt C. MEP Ltd, 2005.
- Johansson K., Albertsson M., Ingvar C., Ekdahl C. Effects of compression bandaging with or without manual lymph drainage treatment in patients with postoperative arm lymphedema // Lymphology. 1999. Vol. 32, № 3. P. 103–110.
- Leduc O., Leduc A., Bourgeois P., Belgrado J.P. The physical treatment of upper limb edema // Cancer. 1998. Vol. 83, № 12 Suppl American. P. 2835–2839.
- Moffatt C., Thomas S., Allegra C., Nelson A., Rabe E., Ágreda J.J.S., Bou J.-E.T., Vowden P., Vin F. Understanding compression therapy. European Wound Management Association (EWMA). Position Document. / ed. Moffatt C. Jane Jones, 2003.
- Thomas S., Nelson A. Types of compression bandage // J Wound Care. 1998. Vol. 7, № 8 Suppl. P. suppl 5-10.
- Rogan S., Taeymans J., Luginbuehl H., Aebi M., Mahnig S., Gebruers N. Therapy modalities to reduce lymphoedema in female breast cancer patients: a systematic review and meta-analysis // Breast Cancer Res Treat. 2016. Vol. 159, № 1. P. 1–14.
- Rabe E., Partsch H., Morrison N., Meissner M.H., Mosti G., Lattimer C.R., Carpentier P.H., Gaillard S., Jünger M., Urbanek T., Hafner J., Patel M., Wu S., Caprini J., Lurie F., Hirsch T. Risks and contraindications of medical compression treatment - A critical reappraisal. An international consensus statement // Phlebology. 2020. Vol. 35, № 7. P. 447–460.
- Партч Х., Партч Б., Браун В. Компрессионное давление и жесткость медицинского трикотажа: сравнение in vivo и in vitro измерений // Флебология. 2010. Vol. 4, № 2. P. 3–10.
- Vale T., Guimaraes T., Libanori D., Baruffi S. Synergistic effect of low elastic compression sleeves in the treatment of lymphedema after breast cancer treatment // J Phlebol Lymphology. 2011. Vol. 4. P. 5–9.
- Williams A. A review of the evidence for adjustable compression wrap devices // J Wound Care. 2016. Vol. 25, № 5. P. 242–247.
- Benigni J.-P., Uhl J.-F., Filori P., Balet F., Penoel L. Adjustable compression wraps: stretch, interface pressures and static stiffness indices // Int Angiol. 2023. Vol. 42, № 3. P. 247–253.
- Wigg J., Lee N. Redefining essential care in lymphoedema // Br J Community Nurs. 2014. Vol. Suppl. P. S20, S22, S24-7.
- Hobday A., Wigg J. Farrow Wrap: innovative and creative patient treatment for lymphoedema // Br JCommunity Nurs. 2013. Vol. 19, № 4. P. 24–31.
- Lawrance S. Use of a Velcro Wrap system in the management of lower limb lymphoedema/ chronic oedema // J Lymphoedema. 2008. Vol. 3, № 2. P. 65–70.
- Pujol-Blaya V., Salinas-Huertas S., Catasús M.L., Pascual T., Belmonte R. Effectiveness of a precast adjustable compression system compared to multilayered compression bandages in the treatment of breast cancer-related lymphoedema: a randomized, single-blind clinical trial // Clin Rehabil. 2019. Vol. 33, № 4. P. 631–641.
- Saffar H. Al. How Can Adjustable Velcro Wraps Help in the Management of Lymphedema in the Absence of Complex Physical Therapy Facilities // Lymphat Res Biol. 2022. Vol. 20, № 4. P. 435–440.
- Mareev V.Y., et al. [Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment] // Kardiologiia. 2018. Vol. 58 Suppl 6. P. 1–164.
- Baumann F.T., Reike A., Reimer V., Schumann M., Hallek M., Taaffe D.R., Newton R.U., Galvao D.A. Effects of physical exercise on breast cancer-related secondary lymphedema: a systematic review // Breast Cancer Res Treat. 2018. Vol. 170, № 1. P. 1–13.
- Wang L., Shi Y.X., Wang T.T., Chen K.X., Shang S.M. Breast cancer-related lymphoedema and resistance exercise: An evidence-based review of guidelines, consensus statements and systematic reviews // J Clin Nurs. 2023. Vol. 32, № 9–10. P. 2208–2227.
- Montaño-Rojas L.S., Romero-Pérez E.M., Medina-Pérez C., Reguera-García M.M., de Paz J.A. Resistance Training in Breast Cancer Survivors: A Systematic Review of Exercise Programs // Int J Environ Res Public Health. 2020. Vol. 17, № 18.
- Trommer M., Marnitz S., Skoetz N., Rupp R., Niels T., Morgenthaler J., Theurich S., von Bergwelt-Baildon M., Baues C., Baumann F.T. Exercise interventions for adults with cancer receiving radiation therapy alone // Cochrane Database Syst Rev. 2023. Vol. 3, № 3. P. CD013448.
- Henriksson A., Johansson B., Radu C., Berntsen S., Igelström H., Nordin K. Is it safe to exercise during oncological treatment? A study of adverse events during endurance and resistance training - data from the Phys-Can study // Acta Oncol. 2021. Vol. 60, № 1. P. 96–105.
- Maltser S., Cristian A., Silver J.K., Morris G.S., Stout N.L. A Focused Review of Safety Considerations in Cancer Rehabilitation // PM R. 2017. Vol. 9, № 9S2. P. S415–S428.
- Ochalek K., Gradalski T., Partsch H. Preventing Early Postoperative Arm Swelling and Lymphedema Manifestation by Compression Sleeves After Axillary Lymph Node Interventions in Breast Cancer Patients: A Randomized Controlled Trial // J Pain Symptom Manage. 2017. Vol. 54, № 3. P. 346–354.
- Ochalek K., Gradalski T., Szygula Z., Partsch H. Physical Activity With and Without Arm Sleeves: Compliance and Quality of Life After Breast Cancer Surgery-A Randomized Controlled Trial // Lymphat Res Biol. 2018. Vol. 16, № 3. P. 294–299.
- Singh B., Newton R.U., Cormie P., Galvao D.A., Cornish B., Reul-Hirche H., Smith C., Nosaka K., Hayes S.C. effects of compression on lymphedema during resistance exercise in women with breast cancer-related lymphedema: a randomized, cross-over trial // Lymphology. 2015. Vol. 48, № 2. P. 80–92.
- Stuiver M.M., ten Tusscher M.R., Agasi-Idenburg C.S., Lucas C., Aaronson N.K., Bossuyt P.M.M. Conservative interventions for preventing clinically detectable upper-limb lymphoedema in patients who are at risk of developing lymphoedema after breast cancer therapy // Cochrane Database Syst Rev. 2015. № 2. P. CD009765.
- Keilani M., Hasenoehrl T., Neubauer M., Crevenna R. Resistance exercise and secondary lymphedema in breast cancer survivors-a systematic review // Support Care Cancer. 2016. Vol. 24, № 4. P. 1907–1916.
- Paramanandam V.S., Roberts D. Weight training is not harmful for women with breast cancer-related lymphoedema: a systematic review // J Physiother. 2014. Vol. 60, № 3. P. 136–143.
- Olsson Möller U., Beck I., Rydén L., Malmström M. A comprehensive approach to rehabilitation interventions following breast cancer treatment - a systematic review of systematic reviews // BMC Cancer. 2019. Vol. 19, № 1. P. 472.
- Karadibak D., Yavuzsen T. Evaluation of kinesthetic sense and hand function in women with breast cancer-related lymphedema // J Phys Ther Sci. 2015. Vol. 27, № 6. P. 1671–1675.
- Líška D., Kováč J., Rutkowski S. Rehabilitation and physical activity in gynecological oncological diseases // Klin Onkol. 2022. Vol. 35, № 2. P. 114–118.
- Sánchez-Lastra M.A., Torres J., Martínez-Lemos I., Ayán C. Nordic walking for women with breast cancer: A systematic review // Eur J Cancer Care (Engl). 2019. Vol. 28, № 6. P. e13130.
- Sanchez-Lastra M.A., Miller K.J., Martínez-Lemos R.I., Giráldez A., Ayán C. Nordic Walking for Overweight and Obese People: A Systematic Review and Meta-Analysis // J Phys Act Health. 2020. Vol. 17, № 7. P. 762–772.
- Maccarone M.C., Venturini E., Menegatti E., Gianesini S., Masiero S. Water-based exercise for upper and lower limb lymphedema treatment // J Vasc Surg Venous Lymphat Disord. 2023. Vol. 11, № 1. P. 201–209.
- Moseley A.L., Carati C.J., Piller N.B. A systematic review of common conservative therapies for arm lymphoedema secondary to breast cancer treatment // Ann Oncol. 2007. Vol. 18, № 4. P. 639–646.
- Johansson K., Tibe K., Kanne L., Skantz H. Controlled physical training for arm lymphedema patients // Lymphology. 2004. Vol. 37. P. 37–39.
- Bradt J., Shim M., Goodill S.W. Dance/movement therapy for improving psychological and physical outcomes in cancer patients // Cochrane Database Syst Rev. 2015. Vol. 1, № 1. P. CD007103.
- Karkou V., et al. Dancing With Health: Quality of Life and Physical Improvements From an EU Collaborative Dance Programme With Women Following Breast Cancer Treatment // Front Psychol. 2021. Vol. 12. P. 635578.
- Moseley A.L., Piller N.B., Carati C.J. The effect of gentle arm exercise and deep breathing on secondary arm lymphedema // Lymphology. 2005. Vol. 38, № 3. P. 136–145.
- Dissemond J., Jockenhöfer F., Miller A., Kurzhals G., Noori S., Reich-Schupke S., Schlaeger M., Schubert E., Stücker M., Weberschock T., Jungkunz H.W. S1 Guidelines - Dermatoses associated with dermal lymphostasis // J Dtsch Dermatol Ges. 2018. Vol. 16, № 4. P. 512–523.
- Hobday A. Skin care protocol: suggesting a routine // Br J Community Nurs. 2023. Vol. 28, № Sup4. P. S12–S14.
- Jones A., Woods M., Malhotra K. Critical examination of skin care self-management in lymphoedema // Br J Community Nurs. 2019. Vol. 24, № Sup10. P. S6–S10.
- Proksch E., Lachapelle J.-M. The management of dry skin with topical emollients--recent perspectives // J Dtsch Dermatol Ges. 2005. Vol. 3, № 10. P. 768–774.
- Miller A. Lymphödem und Haut... aus der Sicht des Dermatologen // LymphForsch. 2005. Vol. 9, № 2. P. 103–106.
- Miller A., Knetsch K. Hautpflege bei lymphostatischen Ödemen // LymphForsch. 2007. Vol. 11, № 1. P. 29–33.
- Майбородин И.В., Нимаев В.В., Шевела А.И., Домников А.В., Павлюк Е.Г., Егоров В.А. Морфология кожи при лимфостазе и лимфоррее // Сибирский научный медицинский журнал. 2005. Vol. 1.
- Iwao F., Sato-Matsumura K.C., Sawamura D., Shimizu H. Elephantiasis nostras verrucosa successfully treated by surgical debridement // Dermatol Surg. 2004. Vol. 30, № 6. P. 939–941.
- Abai B., Zickler R.W., Pappas P.J., Lal B.K., Padberg F.T. Lymphorrhea responds to negative pressure wound therapy // J Vasc Surg. 2007. Vol. 45, № 3. P. 610–613.
- Gradalski T., Kurpiewska J., Ochalek K., Bialon-Janusz A. The application of negative pressure wound therapy combined with compression bandaging for the decubitus ulcer of an advanced primary lower limb lymphedema // Int J Dermatol. 2017. Vol. 56, № 7. P. e144–e147.
- Ассоциация флебологов России, одобрено Научно-практическим Советом МЗ РФ. Варикозное расширение вен нижних конечностей [Электронный ресурс]. 2021. URL: https://cr.minzdrav.gov.ru/recomend/680_1 (дата обращения:24.10.2023).
- Камаев А.А., Булатов В.Л., Вахратьян П.Е., Волков А.М., Волков А.С., Гаврилов Е.К., Головина В.И., Ефремова О.И., Иванов О.О., Илюхин Е.А., Каторкин С.Е., Кончугова Т.В., Кравцов П.Ф., Максимов С.В., Мжаванадзе Н.Д., Пиханова Ж.М., Прядко С.И., Смирнов А.А., Сушков С.А., Чаббаров Р.Г., Шиманко А.И., Якушкин С.Н., Апханова Т.В., Деркачев С.Н., Золотухин И.А., Калинин Р.Е., Кириенко А.И., Кульчицкая Д.Б., Пелевин А.В., Петриков А.С., Рачин А.П., Селиверстов Е.И., Стойко Ю.М., Сучков И.А. Варикозное расширение вен // Флебология. 2022. Vol. 16, № 1. P. 41–108.
- Shaw C., Mortimer P., Judd P.A. A randomized controlled trial of weight reduction as a treatment for breast cancer-related lymphedema // Cancer. 2007. Vol. 110, № 8. P. 1868–1874.
- Phillips J.J., Gordon S.J. Intermittent Pneumatic Compression Dosage for Adults and Children with Lymphedema: A Systematic Review // Lymphat Res Biol. 2019. Vol. 17, № 1. P. 2–18.
- Feldman J.L., Stout N.L., Wanchai A., Stewart B.R., Cormier J.N., Armer J.M. Intermittent pneumatic compression therapy: a systematic review // Lymphology. 2012. Vol. 45, № 1. P. 13–25.
- Marchica P., D’Arpa S., Magno S., Rossi C., Forcina L., Capizzi V., Oieni S., Amato C., Piazza D., Gebbia V. Integrated Treatment of Breast Cancer-related Lymphedema: A Descriptive Review of the State of the Art // Anticancer Res. 2021. Vol. 41, № 7. P. 3233–3246.
- Uzkeser H., Karatay S., Erdemci B., Koc M., Senel K. Efficacy of manual lymphatic drainage and intermittent pneumatic compression pump use in the treatment of lymphedema after mastectomy: a randomized controlled trial // Breast Cancer. 2015. Vol. 22, № 3. P. 300–307.
- Haghighat S., Lotfi-Tokaldany M., Yunesian M., Akbari M.E., Nazemi F., Weiss J. Comparing two treatment methods for post mastectomy lymphedema: complex decongestive therapy alone and in combination with intermittent pneumatic compression // Lymphology. 2010. Vol. 43, № 1. P. 25–33.
- Tastaban E., Soyder A., Aydin E., Sendur O.F., Turan Y., Ture M., Bilgen M. Role of intermittent pneumatic compression in the treatment of breast cancer-related lymphoedema: a randomized controlled trial // Clin Rehabil. 2020. Vol. 34, № 2. P. 220–228.
- тест. 2 test, added to favorites // тест.
- Fife C.E., Davey S., Maus E.A., Guilliod R., Mayrovitz H.N. A randomized controlled trial comparing two types of pneumatic compression for breast cancer-related lymphedema treatment in the home // Support Care Cancer. 2012. Vol. 20, № 12. P. 3279–3286.
- Cannon S. Pneumatic compression devices for in-home management of lymphedema: two case reports // Cases J. 2009. Vol. 2. P. 6625.
- Maldonado T.S., Rokosh R.S., Padberg F., Rotella V., Miller H., Nassiri N., Jacobowitz G., Berland T., Sadek M., Barfield M.E. Assessment of quality of life changes in patients with lower extremity lymphedema using an advanced pneumatic compression device at home // J Vasc Surg Venous Lymphat Disord. 2021. Vol. 9, № 3. P. 745–752.
- Pilch U., Wozniewski M., Szuba A. Influence of compression cycle time and number of sleeve chambers on upper extremity lymphedema volume reduction during intermittent pneumatic compression // Lymphology. 2009. Vol. 42, № 1. P. 26–35.
- Boris M., Weindorf S., Lasinski B.B. The risk of genital edema after external pump compression for lower limb lymphedema // Lymphology. 1998. Vol. 31, № 1. P. 15–20.
- Laracy S. Queensland Health lymphoedema clinical practice guideline 2014 The use of compression in the management of adults with lymphoedema. 2014.
- Finnerty S., Thomason S., Woods M. Audit of the use of kinesiology tape for breast oedema // J Lymphoedema. 2010. Vol. 5, № 1. P. 38–44.
- Marotta N., Lippi L., Ammendolia V., Calafiore D., Inzitari M.T., Pinto M., Invernizzi M., de Sire A. Efficacy of kinesio taping on upper limb volume reduction in patients with breast cancer-related lymphedema: a systematic review of randomized controlled trials // Eur J Phys Rehabil Med. 2023. Vol. 59, № 2. P. 237–247.
- Selcuk Yilmaz S., Ayhan F.F. The Randomized Controlled Study of Low-Level Laser Therapy, Kinesio-Taping and Manual Lymphatic Drainage in Patients With Stage II Breast Cancer-Related Lymphedema // Eur J Breast Health. 2023. Vol. 19, № 1. P. 34–44.
- Pajero Otero V., García Delgado E., Martín Cortijo C., Romay Barrero H.M., de Carlos Iriarte E., Avendaño-Coy J. Kinesio taping versus compression garments for treating breast cancer-related lymphedema: a randomized, cross-over, controlled trial // Clin Rehabil. 2019. Vol. 33, № 12. P. 1887–1897.
- Rodrick J.R., Poage E., Wanchai A., Stewart B.R., Cormier J.N., Armer J.M. Complementary, alternative, and other noncomplete decongestive therapy treatment methods in the management of lymphedema: a systematic search and review // PM R. 2014. Vol. 6, № 3. P. 250–274; quiz 274.
- Герасименко М.Ю., Князева Т.А., Апханова Т.В., Кульчицкая Д.Б. Применение метода кинезиотейпирования в немедикаментозной комплексной реабилитации больных лимфедемой нижних конечностей. Вопросы курортологии, физиотерапии и лечебной физической культуры // Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015. Vol. 92, № 5. P. 22–27.
- Wang Y., Ge Y., Xing W., Liu J., Wu J., Lin H., Lu Y. The effectiveness and safety of low-level laser therapy on breast cancer-related lymphedema: An overview and update of systematic reviews // Lasers Med Sci. 2022. Vol. 37, № 3. P. 1389–1413.
- Walker J., Tanna S., Roake J., Lyons O. A systematic review of pharmacologic and cell-based therapies for treatment of lymphedema (2010-2021) // J Vasc Surg Venous Lymphat Disord. 2022. Vol. 10, № 4. P. 966-975.e1.
- Forte A.J., Boczar D., Huayllani M.T., Lu X., McLaughlin S.A. Pharmacotherapy Agents in Lymphedema Treatment: A Systematic Review // Cureus. 2019. Vol. 11, № 12. P. e6300.
- Brown S., Dayan J.H., Coriddi M., Campbell A., Kuonqui K., Shin J., Park H.J., Mehrara B.J., Kataru R.P. Pharmacological Treatment of Secondary Lymphedema // Front Pharmacol. 2022. Vol. 13. P. 828513.
- Forte A.J., Boczar D., Huayllani M.T., McLaughlin S.A., Bagaria S. Topical Approach to Delivering Targeted Therapies in Lymphedema Treatment: A Systematic Review // Cureus. 2019. Vol. 11, № 12. P. e6269.
- Badger C., Preston N., Seers K., Mortimer P. Benzo-pyrones for reducing and controlling lymphoedema of the limbs // Cochrane Database Syst Rev. 2004. Vol. 2004, № 2. P. CD003140.
- Cattell W.R., Taylor G.W., Aitken D. Diuretic therapy of primary lymphoedema // Lancet. 1965. Vol. 2, № 7407. P. 312–315.
- Stolarz A.J., Lakkad M., Klimberg V.S., Painter J.T. Calcium Channel Blockers and Risk of Lymphedema among Breast Cancer Patients: Nested Case-Control Study // Cancer Epidemiol Biomarkers Prev. 2019. Vol. 28, № 11. P. 1809–1815.
- Sung C.J., Gupta K., Wang J., Wong A.K. Lymphatic Tissue Bioengineering for the Treatment of Postsurgical Lymphedema // Bioengineering (Basel). 2022. Vol. 9, № 4.
- Jia W., Hitchcock-Szilagyi H., He W., Goldman J., Zhao F. Engineering the Lymphatic Network: A Solution to Lymphedema // Adv Healthc Mater. 2021. Vol. 10, № 6. P. e2001537.
- Asaad M., Hanson S.E. Tissue Engineering Strategies for Cancer-Related Lymphedema // Tissue Eng Part A. 2021. Vol. 27, № 7–8. P. 489–499.
- Brorson H. Liposuction in Lymphedema Treatment // J Reconstr Microsurg. 2016. Vol. 32, № 1. P. 56–65.
- Chang D.W., Dayan J., Greene A.K., MacDonald J.K., Masia J., Mehrara B., Neligan P.C., Nguyen D. Surgical Treatment of Lymphedema: A Systematic Review and Meta-Analysis of Controlled Trials. Results of a Consensus Conference // Plast Reconstr Surg. 2021. Vol. 147, № 4. P. 975–993.
- Masia J., Olivares L., Koshima I., Teo T.C., Suominen S., Van Landuyt K., Demirtas Y., Becker C., Pons G., Garusi C., Mitsunaga N. Barcelona consensus on supermicrosurgery // J Reconstr Microsurg. 2014. Vol. 30, № 1. P. 53–58.
- Servelle M. Surgical treatment of lymphedema: a report on 652 cases // Surgery. 1987. Vol. 101, № 4. P. 485–495.
- Dumanian G.A., Futrell J.W. Radical excision and delayed reconstruction of a lymphedematous leg with a 15 year follow-up // Lymphology. 1996. Vol. 29, № 1. P. 20–24.
- Miller T.A., Wyatt L.E., Rudkin G.H. Staged skin and subcutaneous excision for lymphedema: a favorable report of long-term results // Plast Reconstr Surg. 1998. Vol. 102, № 5. P. 1486–1498; discussion 1499-501.
- Mehrara B. Surgical treatment of primary and secondary lymphedema - UpToDate [Электронный ресурс]. 2023. URL: https://www.uptodate.com/contents/surgical-treatment-of-primary-and-secondary-lymphedema?search=Surgical%20treatment%20of%20primary%20and%20secondary%20lymphedema&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1 (дата обращения:19.10.2023).
- Forte A.J., Huayllani M.T., Boczar D., Ciudad P., McLaughlin S.A. Lipoaspiration for the Treatment of Lower Limb Lymphedema: A Comprehensive Systematic Review // Cureus. 2019. Vol. 11, № 10. P. e5913.
- Forte A.J., Huayllani M.T., Boczar D., Cinotto G., McLaughlin S.A. Lipoaspiration and Controlled Compressive Therapy in Lymphedema of the Upper Extremity: A Comprehensive Systematic Review // Cureus. 2019. Vol. 11, № 9. P. e5787.
- Brorson H., Ohlin K., Olsson G., Svensson B., Svensson H. Controlled compression and liposuction treatment for lower extremity lymphedema // Lymphology. 2008. Vol. 41, № 2. P. 52–63.
- Brorson H. From lymph to fat: liposuction as a treatment for complete reduction of lymphedema // Int J Low Extrem Wounds. 2012. Vol. 11, № 1. P. 10–19.
- Forte A.J., Khan N., Huayllani M.T., Boczar D., Saleem H.Y., Lu X., Manrique O.J., Ciudad P., McLaughlin S.A. Lymphaticovenous Anastomosis for Lower Extremity Lymphedema: A Systematic Review // Indian J Plast Surg. 2020. Vol. 53, № 1. P. 17–24.
- Meuli J.N., Guiotto M., Elmers J., Mazzolai L., di Summa P.G. Outcomes after microsurgical treatment of lymphedema: a systematic review and meta-analysis // Int J Surg. 2023. Vol. 109, № 5. P. 1360–1372.
- Damstra R.J., Voesten H.G.J., van Schelven W.D., van der Lei B. Lymphatic venous anastomosis (LVA) for treatment of secondary arm lymphedema. A prospective study of 11 LVA procedures in 10 patients with breast cancer related lymphedema and a critical review of the literature // Breast Cancer Res Treat. 2009. Vol. 113, № 2. P. 199–206.
- Wolfs J.A.G.N., de Joode L.G.E.H., van der Hulst R.R.W.J., Qiu S.S. Correlation between patency and clinical improvement after lymphaticovenous anastomosis (LVA) in breast cancer-related lymphedema: 12-month follow-up // Breast Cancer Res Treat. 2020. Vol. 179, № 1. P. 131–138.
- Basta M.N., Gao L.L., Wu L.C. Operative treatment of peripheral lymphedema: a systematic meta-analysis of the efficacy and safety of lymphovenous microsurgery and tissue transplantation // Plast Reconstr Surg. 2014. Vol. 133, № 4. P. 905–913.
- Kong X., Du J., Du X., Cong X., Zhao Q. A Meta-analysis of 37 Studies on the Effectiveness of Microsurgical Techniques for Lymphedema // Ann Vasc Surg. 2022. Vol. 86. P. 440-451.e6.
- Grünherz L., Hulla H., Uyulmaz S., Giovanoli P., Lindenblatt N. Patient-reported outcomes following lymph reconstructive surgery in lower limb lymphedema: A systematic review of literature // J Vasc Surg Venous Lymphat Disord. 2021. Vol. 9, № 3. P. 811-819.e2.
- Tang N.S.J., Ramakrishnan A., Shayan R. Quality-of-life outcomes after operative management of primary and secondary lymphoedema: a systematic review // ANZ J Surg. 2021. Vol. 91, № 12. P. 2624–2636.
- Verhey E.M., Kandi L.A., Lee Y.S., Morris B.E., Casey W.J., Rebecca A.M., Marks L.A., Howard M.A., Teven C.M. Outcomes of Lymphovenous Anastomosis for Lower Extremity Lymphedema: A Systematic Review // Plast Reconstr Surg Glob Open. 2022. Vol. 10, № 10. P. e4529.
- Zeltzer A.A., Hamdi M. Operative treatment of peripheral lymphedema: a systematic meta-analysis of the efficacy and safety of lymphovenous microsurgery and tissue transplant // Plast Reconstr Surg. 2014. Vol. 134, № 3. P. 491e–492e.
- Campisi C., Bellini C., Campisi C., Accogli S., Bonioli E., Boccardo F. Microsurgery for lymphedema: clinical research and long-term results // Microsurgery. 2010. Vol. 30, № 4. P. 256–260.
- Cha H.G., Oh T.M., Cho M.-J., Pak C.S.J., Suh H.P., Jeon J.Y., Hong J.P. Changing the Paradigm: Lymphovenous Anastomosis in Advanced Stage Lower Extremity Lymphedema // Plast Reconstr Surg. 2021. Vol. 147, № 1. P. 199–207.
- Gupta N., Verhey E.M., Torres-Guzman R.A., Avila F.R., Jorge Forte A., Rebecca A.M., Teven C.M. Outcomes of Lymphovenous Anastomosis for Upper Extremity Lymphedema: A Systematic Review // Plast Reconstr Surg Glob Open. 2021. Vol. 9, № 8. P. e3770.
- Pak C.S., Suh H.P., Kwon J.G., Cho M.-J., Hong J.P. Lymph Node to Vein Anastomosis (LNVA) for lower extremity lymphedema // J Plast Reconstr Aesthet Surg. 2021. Vol. 74, № 9. P. 2059–2067.
- Dionyssiou D., Demiri E., Tsimponis A., Sarafis A., Mpalaris V., Tatsidou G., Arsos G. A randomized control study of treating secondary stage II breast cancer-related lymphoedema with free lymph node transfer // Breast Cancer Res Treat. 2016. Vol. 156, № 1. P. 73–79.
- Yamamoto T., Yoshimatsu H., Narushima M., Yamamoto N., Hayashi A., Koshima I. Indocyanine Green Lymphography Findings in Primary Leg Lymphedema // Eur J Vasc Endovasc Surg. 2015. Vol. 49, № 1. P. 95–102.
- Pandey S.K., Fahradyan V., Orfahli L.M., Chen W.F. Supermicrosurgical lymphaticovenular anastomosis vs. vascularized lymph vessel transplant - technical optimization and when to perform which // Plast Aesthet Res. 2022. Vol. 8, № 8. P. 47.
- Yamamoto T., Iida T., Yoshimatsu H., Fuse Y., Hayashi A., Yamamoto N. Lymph Flow Restoration after Tissue Replantation and Transfer: Importance of Lymph Axiality and Possibility of Lymph Flow Reconstruction without Lymph Node Transfer or Lymphatic Anastomosis // Plast Reconstr Surg. 2018. Vol. 142, № 3. P. 796–804.
- Chen W.F., McNurlen M.M., Bowen M. Surgical treatments of lymphedema // Bostwick’s Plastic and Reconstructive Breast Surgery. Fourth. New-York: Thieme Medical Publishers, 2020. P. 1478–1499.
- Knackstedt R., Chen W.F. Current Concepts in Surgical Management of Lymphedema // Phys Med Rehabil Clin N Am. 2022. Vol. 33, № 4. P. 885–899.
- Forte A.J., Huayllani M.T., Boczar D., Ciudad P., Manrique O. Lipoaspiration and Lymph Node Transfer for Treatment of Breast Cancer-related Lymphedema: A Systematic Review // Cureus. 2019. Vol. 11, № 11. P. e6096.
- Pusic A.L., Cemal Y., Albornoz C., Klassen A., Cano S., Sulimanoff I., Hernandez M., Massey M., Cordeiro P., Morrow M., Mehrara B. Quality of life among breast cancer patients with lymphedema: a systematic review of patient-reported outcome instruments and outcomes // J Cancer Surviv. 2013. Vol. 7, № 1. P. 83–92.
- Cemal Y., Jewell S., Albornoz C.R., Pusic A., Mehrara B.J. Systematic review of quality of life and patient reported outcomes in patients with oncologic related lower extremity lymphedema // Lymphat Res Biol. 2013. Vol. 11, № 1. P. 14–19.
- Fish M.L., Grover R., Schwarz G.S. Quality-of-Life Outcomes in Surgical vs Nonsurgical Treatment of Breast Cancer-Related Lymphedema: A Systematic Review // JAMA Surg. 2020. Vol. 155, № 6. P. 513–519.
- Abbasi B., Mirzakhany N., Angooti Oshnari L., Irani A., Hosseinzadeh S., Tabatabaei S.M., Haghighat S. The effect of relaxation techniques on edema, anxiety and depression in post-mastectomy lymphedema patients undergoing comprehensive decongestive therapy: A clinical trial // PLoS One. 2018. Vol. 13, № 1. P. e0190231.
- Fu M.R., Ridner S.H., Hu S.H., Stewart B.R., Cormier J.N., Armer J.M. Psychosocial impact of lymphedema: a systematic review of literature from 2004 to 2011 // Psychooncology. 2013. Vol. 22, № 7. P. 1466–1484.
- Bowman C., Piedalue K.-A., Baydoun M., Carlson L.E. The Quality of Life and Psychosocial Implications of Cancer-Related Lower-Extremity Lymphedema: A Systematic Review of the Literature // J Clin Med. 2020. Vol. 9, № 10.
- Reger M., Kutschan S., Freuding M., Schmidt T., Josfeld L., Huebner J. Water therapies (hydrotherapy, balneotherapy or aqua therapy) for patients with cancer: a systematic review // J Cancer Res Clin Oncol. 2022. Vol. 148, № 6. P. 1277–1297.
- Yeung W., Semciw A.I. Aquatic Therapy for People with Lymphedema: A Systematic Review and Meta-analysis // Lymphat Res Biol. 2018. Vol. 16, № 1. P. 9–19.
- Ergin G., Karadibak D., Sener H.O., Gurpinar B. Effects of Aqua-Lymphatic Therapy on Lower Extremity Lymphedema: A Randomized Controlled Study // Lymphat Res Biol. 2017. Vol. 15, № 3. P. 284–291.
- Chaput G., Ibrahim M., Towers A. Cancer-related lymphedema: clinical pearls for providers // Curr Oncol. 2020. Vol. 27, № 6. P. 336–340.
- Soran A., Ozmen T., McGuire K.P., Diego E.J., McAuliffe P.F., Bonaventura M., Ahrendt G.M., DeGore L., Johnson R. The importance of detection of subclinical lymphedema for the prevention of breast cancer-related clinical lymphedema after axillary lymph node dissection; a prospective observational study // Lymphat Res Biol. 2014. Vol. 12, № 4. P. 289–294.
- Soran A., Menekse E., Girgis M., DeGore L., Johnson R. Breast cancer-related lymphedema after axillary lymph node dissection: does early postoperative prediction model work? // Support Care Cancer. 2016. Vol. 24, № 3. P. 1413–1419.
- Yang E.J., Ahn S., Kim E.-K., Kang E., Park Y., Lim J.-Y., Kim S.-W. Use of a prospective surveillance model to prevent breast cancer treatment-related lymphedema: a single-center experience // Breast Cancer Res Treat. 2016. Vol. 160, № 2. P. 269–276.
- Martínez-Jaimez P., Fuster Linares P., Masià J., Jané P., Monforte-Royo C. Temporal validation of a risk prediction model for breast cancer-related lymphoedema in European population: A retrospective study // J Adv Nurs. 2023.
- McLaughlin S.A., Stout N.L., Schaverien M. V. Avoiding the Swell: Advances in Lymphedema Prevention, Detection, and Management // Am Soc Clin Oncol Educ Book. 2020. Vol. 40. P. 1–10.
- Fu M.R., Axelrod D., Haber J. Breast-cancer-related lymphedema: information, symptoms, and risk-reduction behaviors // J Nurs Scholarsh. 2008. Vol. 40, № 4. P. 341–348.
- Fu M.R., Chen C.M., Haber J., Guth A.A., Axelrod D. The effect of providing information about lymphedema on the cognitive and symptom outcomes of breast cancer survivors // Ann Surg Oncol. 2010. Vol. 17, № 7. P. 1847–1853.
- Rafn B.S., McNeely M.L., Camp P.G., Midtgaard J., Campbell K.L. Self-Measured Arm Circumference in Women With Breast Cancer Is Reliable and Valid // Phys Ther. 2019. Vol. 99, № 2. P. 240–253.
- NLN Medical Advisory Committee. Lymphedema Risk Reduction Practices. Position Statement of the National Lymphedema Network. 2012 [Электронный ресурс]. URL: https://clck.ru/35Wnnx (дата обращения:30.10.2023).
- Showalter S.L., Brown J.C., Cheville A.L., Fisher C.S., Sataloff D., Schmitz K.H. Lifestyle risk factors associated with arm swelling among women with breast cancer // Ann Surg Oncol. 2013. Vol. 20, № 3. P. 842–849.
- Ferguson C.M., Swaroop M.N., Horick N., Skolny M.N., Miller C.L., Jammallo L.S., Brunelle C., O’Toole J.A., Salama L., Specht M.C., Taghian A.G. Impact of Ipsilateral Blood Draws, Injections, Blood Pressure Measurements, and Air Travel on the Risk of Lymphedema for Patients Treated for Breast Cancer // J Clin Oncol. 2016. Vol. 34, № 7. P. 691–698.
- Co M., Ng J., Kwong A. Air Travel and Postoperative Lymphedema-A Systematic Review // Clin Breast Cancer. 2018. Vol. 18, № 1. P. e151–e155.
- Casley-Smith J.R., Casley-Smith J.R. Lymphedema initiated by aircraft flights // Aviat Space Environ Med. 1996. Vol. 67, № 1. P. 52–56.
- Graham P.H. Compression prophylaxis may increase the potential for flight-associated lymphoedema after breast cancer treatment // Breast. 2002. Vol. 11, № 1. P. 66–71.
- Swenson K.K., Nissen M.J., Leach J.W., Post-White J. Case-control study to evaluate predictors of lymphedema after breast cancer surgery // Oncol Nurs Forum. 2009. Vol. 36, № 2. P. 185–193.
- Ochalek K., Partsch H., Gradalski T., Szygula Z. Do Compression Sleeves Reduce the Incidence of Arm Lymphedema and Improve Quality of Life? Two-Year Results from a Prospective Randomized Trial in Breast Cancer Survivors // Lymphat Res Biol. 2019. Vol. 17, № 1. P. 70–77.
- Paramanandam V.S., Dylke E., Clark G.M., Daptardar A.A., Kulkarni A.M., Nair N.S., Badwe R.A., Kilbreath S.L. Prophylactic Use of Compression Sleeves Reduces the Incidence of Arm Swelling in Women at High Risk of Breast Cancer-Related Lymphedema: A Randomized Controlled Trial // J Clin Oncol. 2022. Vol. 40, № 18. P. 2004–2012.
- Nadal Castells M.J., Ramirez Mirabal E., Cuartero Archs J., Perrot Gonzalez J.C., Beranuy Rodriguez M., Pintor Ojeda A., Bascuñana Ambros H. Effectiveness of Lymphedema Prevention Programs With Compression Garment After Lymphatic Node Dissection in Breast Cancer: A Randomized Controlled Clinical Trial // Front Rehabil Sci. 2021. Vol. 2. P. 727256.
- Roberts S.A., Gillespie T.C., Shui A.M., Brunelle C.L., Daniell K.M., Locascio J.J., Naoum G.E., Taghian A.G. Weight loss does not decrease risk of breast cancer-related arm lymphedema // Cancer. 2021. Vol. 127, № 21. P. 3939–3945.
- Yoon J.A., Lee H.S., Lee J.W., Kim J.H. Six-Month Follow-up for Investigating the Effect of Prophylactic Lymphovenous Anastomosis on the Prevention of Breast Cancer-Related Lymphedema: A Preliminary Study in a Single Institution // Archives of Hand and Microsurgery. Korean Society for Surgery of the Hand and Korean Society for Microsurgery, 2021. Vol. 26, № 4. P. 276–284.
- Boccardo F.M., Casabona F., Friedman D., Puglisi M., De Cian F., Ansaldi F., Campisi C. Surgical prevention of arm lymphedema after breast cancer treatment // Ann Surg Oncol. 2011. Vol. 18, № 9. P. 2500–2505.
- Yamamoto T., Yamamoto N., Yamashita M., Furuya M., Hayashi A., Koshima I. Efferent Lymphatic Vessel Anastomosis: Supermicrosurgical Efferent Lymphatic Vessel-to-Venous Anastomosis for the Prophylactic Treatment of Subclinical Lymphedema // Ann Plast Surg. 2016. Vol. 76, № 4. P. 424–427.
- Takeishi M., Kojima M., Mori K., Kurihara K., Sasaki H. Primary intrapelvic lymphaticovenular anastomosis following lymph node dissection // Ann Plast Surg. 2006. Vol. 57, № 3. P. 300–304.
- Douglass J., Graves P., Gordon S. Self-Care for Management of Secondary Lymphedema: A Systematic Review // PLoS Negl Trop Dis. 2016. Vol. 10, № 6. P. e0004740.
- Temur K., Kapucu S. The effectiveness of lymphedema self-management in the prevention of breast cancer-related lymphedema and quality of life: A randomized controlled trial // Eur J Oncol Nurs. 2019. Vol. 40. P. 22–35.
- Cansız G., Arıkan Dönmez A., Kapucu S., Borman P. The effect of a self-management lymphedema education program on lymphedema, lymphedema-related symptoms, patient compliance, daily living activities and patient activation in patients with breast cancer-related lymphedema: A quasi-experimental study // Eur J Oncol Nurs. 2022. Vol. 56. P. 102081.
- Рубрикатор КР [Электронный ресурс]. URL: https://cr.minzdrav.gov.ru/recomend/680_1 (дата обращения:31.10.2023).
- Stewart C.J., Munnoch D.A. Liposuction as an effective treatment for lower extremity lymphoedema: A single surgeon’s experience over nine years // J Plast Reconstr Aesthet Surg. 2018. Vol. 71, № 2. P. 239–245.
- Loh C.Y.Y., Wu J.C.-W., Nguyen A., Dayan J., Smith M., Masia J., Chang D., Koshima I., Cheng M.-H. The 5th world symposium for lymphedema surgery-Recent updates in lymphedema surgery and setting up of a global knowledge exchange platform // J Surg Oncol. 2017. Vol. 115, № 1. P. 6–12.
- Chang E.I., Skoracki R.J., Chang D.W. Lymphovenous Anastomosis Bypass Surgery // Semin Plast Surg. 2018. Vol. 32, № 1. P. 22–27.
- Chan J.C.Y., Taranto G. Di, Elia R., Amorosi V., Sitpahul N., Chen H.-C. Postoperative care after lymphaticovenous anastomosis // Arch Plast Surg. 2021. Vol. 48, № 3. P. 333–335.
- Chen W.F., Bowen M., Ding J. Immediate Limb Compression Following Supermicrosurgical Lymphaticovenular Anastomosis – Is It Helpful or Harmful? // International Microsurgery Journal. 2018. Vol. 2, № 1.
- Yamamoto T., Yamamoto N., Kageyama T., Sakai H., Fuse Y., Tsuihiji K., Tsukuura R. Technical pearls in lymphatic supermicrosurgery // . Glob Health Med. 2020. Vol. 2, № 1. P. 29–32.
- Venkatramani H., Shanmugakrishnan R.R., Kumaran M.S., Sabapathy S.R. Surgical debulking, lymphatico venous anastomosis, vascularised lymph node transfer in lower limb lymphoedema // Plast Aesthet Res. 2020. Vol. 2020.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Апханова Т.В., к.м.н., член Российского кардиологического общества (РКО), член Американского вено-лимфатического общества (AVLS), член Европейского общества кардиологов (ESC);
- Байтингер В.Ф., д.м.н., профессор, член Российского общества пластических, реконструктивных и эстетических хирургов, член Ассоциации лимфологов России (АЛР), член общества Кистевых Хирургов "Кистевая группа", член Deutsche Gesellschaft fuer Plastische und Wiederherstellungschirurgie;
- Белянина Е.О., член Ассоциации флебологов России (АФР);
- Букина О.В., к.м.н., член Ассоциации флебологов России (АФР);
- Дамато Андреа; член Ассоциации лимфологов России (АЛР), Ассоциации физических терапевтов Мальты (Malta Association of physiotherapists);
- Демехова М.Ю., член Ассоциации флебологов России (АФР), Ассоциации лимфологов России (АЛР), International Lipoedema Association;
- Золотухин И.А., д.м.н., профессор, профессор РАН, исполнительный секретарь Ассоциации флебологов России (АФР);
- Илюхин Е.А., к.м.н., вице-президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ);
- Калинин Р.Е., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), член правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), член European Society for Vascular Surgery (ESVS);
- Каторкин С.Е., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), член Ассоциации колопроктологов России (АКР);
- Кончугова Т.В., д.м.н., профессор, член Национальной Ассоциации экспертов по санаторно-курортному лечению;
- Кульчицкая Д.Б., д.м.н., профессор, член Национальной Ассоциации экспертов по санаторно-курортному лечению;
- Курочкина О.С., к.м.н., член Российского общества пластических, реконструктивных и эстетических хирургов, член Ассоциации лимфологов России (АЛР), член общества Кистевых Хирургов "Кистевая группа";
- Кушнарчук М.Ю., член Ассоциации флебологов России (АФР);
- Летягин А.Ю., д.м.н., профессор, член Ассоциации врачей рентгенологов, радиологов, врачей ультразвуковой диагностики и врачей по рентгеноэндоваскулярным диагностике и лечению Сибирского федерального округа (САРР), член Научного медицинского общества анатомов, гистологов и эмбриологов России (НМОАГЭ);
- Макаров И.Г., исполнительный директор Ассоциации лимфологов России (АЛР), член Международного (ISL) и Европейского (ESL) обществ лимфологов;
- Макарова Н.В., член Ассоциации лимфологов России (АЛР);
- Мельников М.А., к.м.н., доцент, член Ассоциации флебологов России (АФР), Российского общества хирургов (РОХ);
- Мышенцев П.Н., к.м.н., доцент, член Ассоциации флебологов России (АФР), Российского общества хирургов (РОХ);
- Николаева Е.С., член Ассоциации лимфологов России (АЛР);
- Нимаев В.В., д.м.н., член Ассоциации лимфологов России (АЛР);
- Прядко С.И., к.м.н., член Ассоциации флебологов России (АФР), член Ассоциации сердечно-сосудистых хирургов России (АССХ);
- Ровная А.В., административный директор Ассоциации лимфологов России (АЛР), Russia Chapter Chairman of the Lymphatic Educational and research Network (LE&RN), член International Lipedema Association; European Lymphology Society, International Society of Lymphology, International Lymphedema Framework, Limfedema Romania;
- Сапелкин С.В., д.м.н., профессор, член Ассоциации флебологов России (АФР), Российского общества ангиологов и сосудистых хирургов (РОАиСХ), Европейского общества ангиологов, Американского венозного форума (AVF);
- Светликов А. В., д.м.н., доцент, член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS);
- Сильчук Е.С., к.м.н., член Ассоциации лимфологов России (АЛР);
- Синицын А.А., член Ассоциации флебологов России (АФР);
- Стойко Ю.М., д.м.н., профессор, Почетный президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Российского общества ангиологов и сосудистых хирургов (РОАиСХ);
- Сучков И.А., д.м.н., профессор, президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), European Society for Vascular Surgery (ESVS);
- Уртаев Б.М., д.м.н., профессор, президент Ассоциации лимфологов России (АЛР);
- Фейсханов А.К., к.м.н., член Ассоциации лимфологов России (АЛР);
- Филина Ю.В., к.б.н.;
- Фионик О.В., д.м.н., доцент, член Ассоциации лимфологов России (АЛР), Российского общества ангиологов и сосудистых хирургов (РОАиСХ);
- Черняго Т.Ю., к.м.н., член Ассоциации флебологов России (АФР);
- Шевела А.И., д.м.н., профессор, член Ассоциации флебологов России (АФР), Российского общества хирургов (РОХ), Российского общества эндоскопических хирургов (РОЭХ);
- Яровенко Г.В., д.м.н., доцент, член Ассоциации флебологов России (АФР).
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки или другого конфликта интересов при составлении данных рекомендаций.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врач - сердечно-сосудистый хирург;
- Врач по рентгенэндоваскулярным диагностике и лечению;
- Врач - хирург;
- Врач ультразвуковой диагностики;
- Врач-терапевт;
- Врач-кардиолог;
- Врач по лечебной физкультуре;
- Врач по медицинской реабилитации;
- Врач-педиатр;
- Врач травматолог-ортопед;
- Врач-онколог;
- Студенты медицинских ВУЗов, ординаторы, аспиранты.
Рекомендации основаны на совокупном анализе доказательств, представленных в мировой литературе и полученных в результате клинического применения современных принципов и методов диагностики и лечения лимфедемы конечностей. Основные положения Рекомендаций ранжируются в соответствии с Приказом Министерства здравоохранения РФ от 28 февраля 2019 г. № 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации”. Рекомендации подготовлены в соответствии с Методическими рекомендациями по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Министерства здравоохранения Российской Федерации, 2019 г.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Приложение А 3.1. Дифференциальная диагностика лимфедемы, липедемы и ожирения
Таблица составлена с использованием материалов руководства Best Practice Guidelines The Management of Lipoedema [147]
|
Признак |
Липедема |
Лимфедема |
Ожирение |
|
Пол |
Ж (почти исключительно) |
Ж и М |
Ж и М |
|
Возраст начала |
Пубертат (возраст полового созревания) или период гормональных изменений |
Любой возраст Первичная м.б. в детском возрасте (до пубертата) |
Любой возраст |
|
Семейная история |
Возможна |
Возможна (характерна для первичной лимфедемы) |
Возможна |
|
ИМТ |
Может быть N или повышена |
Может быть N или повышена |
Увеличен всегда |
|
Соотношение окружностей талии и бедер |
N (Ж <0.85, M <0.9) |
N (Ж <0.85, M <0.9) |
>N (Ж >0.85, M >0.9) |
|
Симметричность |
Симметрично билатерально |
Асимметрично, унилатерально/билатерально |
Симметрично |
|
Локализация (вовлечение туловища) |
Туловище не вовлечено
|
Туловище может быть вовлечено при отеке корпуса |
Преимущественно туловище |
|
Отек кистей/стоп |
Нет |
Возможен |
Нет |
|
Отек с ямкой |
Нет |
Есть чаще всего
|
Нет |
|
Легко образуются кровоподтеки |
Да |
Нет |
Нет |
|
Боль/дискомфорт в зонах поражения |
Да |
Нет (м.б. дискомфорт) |
Нет |
|
Болезненность в зонах поражения |
Да |
Нет |
Нет |
|
Консистенция кожи |
Нормальная/мягкая |
Плотная |
Нормальная |
|
История инфекционного целлюлита/рожи |
Нет |
Часто |
Нет |
|
Симптом Стеммера |
Нет |
Возможен |
Нет |
|
Гиперкератоз |
Нет |
Возможен |
Нет |
|
Эффект от КФПТ |
Нет |
Да |
Нет |
|
Эффект от диеты, физических нагрузок |
Нет (есть при сочетании с ожирением) |
Возможен, опосредован, не сильно выражен |
Есть, выраженный |
|
Эффект от подъёма конечности |
Нет |
Есть на ранней стадии |
Нет |
|
Лимфосцинтиграфия |
Норма |
Патология |
Норма |
Приложение А 3.2. Основные компоненты компрессионного многослойного бандажа (КМБ) [78]
|
|
Компонент |
Назначение |
Характеристики |
Примечания |
|
1 |
Уход за кожей |
Уход за кожей и лечение кожных поражений |
По показаниям |
Как минимум должны использоваться эмоленты для увлажнения и защиты кожи |
|
2 |
Бинтование пальцев конечности |
Для профилактики появления или уменьшения отека пальцев |
|
Бандаж не должен нарушать подвижность пальцев |
|
3 |
Защищающий и изолирующий слой (трубчатый бинт) |
Защищающий кожу и абсорбирующий слой между кожей и остальными компонентами КМБ |
Легкий хлопковый (или с вискозой) трубчатый бинт на всю длину бандажа, не создающий компрессии |
Бинт должен быть достаточно длинным, чтобы его можно было откинуть поверх основного слоя в паху или подмышечной впадине для защиты кожи от натирания |
|
4 |
Заполняющий и формирующий слой (синтетическая вата) |
Моделирование формы конечности для распределения давления, создаваемого основным компрессионным слоем, защиты кожи над костными выступами |
Синтетическая вата или поролон в виде бинтов или листов |
Могут потребоваться дополнительные слои в уязвимых зонах (ахиллово сухожилие, тыльная поверхность стопы, передняя поверхность большеберцовой кости, лодыжки, подколенная ямка и локоть) |
|
5 |
Дополнительные прокладки |
Создание локального повышенного давления для размягчения плотных тканей или в зонах выраженного отека |
Изделия из полиуретана или других материалов высокой плотности (подушечки, лимфопрокладки, lymphpads) |
Накладываются поверх 4 компонента (синтетической ваты) |
|
6 |
Компрессионный слой |
Создание компрессии |
Бинты короткой или (реже) средней растяжимости |
Накладывается в несколько слоев |
|
7 |
Фиксирующий слой |
Предотвращение сползания и деформации бандажа |
Пластырь или когезивные бинты |
|
Приложение А 3.3. Протокол ежедневного ухода за кожей конечности с лимфедемой
Протокол ежедневного ухода за кожей разработан на основании протокола All-Ireland Lymphoedema Guidelines 2022 г., в котором использованы материалы 2 тематических обзоров литературы, а также дополнений от Hobday A [72,105,372,373].
|
Этап |
Содержание и особенности |
|
Физикальное обследование |
Проведите тщательный осмотр конечности для выявления изменений кожи (например, повышенная сухость, очаги воспаления/инфекции, повреждения). Осмотр должен включать все кожные складки пораженной конечности. Обращайте внимание на локальную гипертермию при пальпации, которая может быть признаком инфекции. |
|
Очистка |
Для очистки кожи использовать теплую воду. Рекомендуется вместо мыла использовать его заменители на водной или масляной основе (например, Aqueous cream). Такие заменители не обладают подсушивающим и раздражающим эффектами. Для снижения риска развития грибковой инфекции особую осторожность следует соблюдать при уходе за межпальцевыми промежутками. Межпальцевые промежутки должны быть высушены при каждой процедуре ухода за кожей. Если вода и мыло/заменители мыла недоступны, следует использовать очищающие спреи. В случае необходимости, при хорошей переносимости пациентом и отсутствии трещин в зоне применения могут применяться кератолитические средства (местные средства на основе салициловой кислоты или мочевины). |
|
Увлажнение |
Увлажняющий крем необходимо наносить не реже одного раза в день, предпочтительно дважды. Цель применения увлажняющего крема - остановить испарение воды с кожи. Если после нанесения увлажняющего средства необходимо надеть одежду или компрессионное изделие, рекомендуется подождать 30 минут. Необходимо увлажнять кожу на ночь, после снятия компрессионного изделия и одежды. Перед увлажнением кожа должна быть очищена от остатков предыдущей обработки и загрязнений. |
|
Избегать повреждения кожи |
Защита от повреждений кожи является профилактикой инфекционных осложнений. Следует применять меры предосторожности при работе на даче, прогулках (избегать и проводить профилактику порезов, уколов, укусов насекомых. При каких-либо работах рекомендуется использовать защитные перчатки). Порезы следует обрабатывать антисептиком. Избегать и проводить профилактику солнечных ожогов. Избегать потертостей от ношения обуви на конечности с лимфедемой (удобная обувь). Уход за ногтями (поддержание их «короткими»). Не рекомендуется брать кровь или вводить препараты в пораженную конечность. |
|
Особенности удаления нежелательных волос |
Нежелательные волосы рекомендуется удалять над волосяным фолликулом, а не извлекать из фолликула (чтобы не формировались открытые ворота инфекции). Рекомендуется использовать электрические бритвы или кремы для депиляции. Не рекомендуется использовать выщипывание, восковую или другую механическую эпиляцию и бритье конечности с лимфедемой безопасной бритвой. |
Приложение А 3.4. Рекомендации по ЛФК для пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности
Рекомендации по ЛФК для пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности по данным зонтичного систематического обзора Wang L. с соавт., 2023 г [349].
|
Безопасность тренировок с отягощениями |
|
Упражнения с отягощениями безопасны для пациентов, прошедших лечение по поводу РМЖ, без увеличения риска развития лимфедемы |
|
Упражнения с отягощениями безопасны для пациентов, прошедших лечение по поводу РМЖ со стабильной лимфедемой (отсутствие необходимости в терапии лимфедемы в течение последних 3 месяцев, отсутствие недавней инфекции конечностей, требующей антибиотиков, изменение окружности конечностей <10%, снижение способности выполнять повседневные физические задачи) |
|
Упражнения с отягощениями не рекомендуются пациентам с выраженной анемией, испытывающим сильную усталость или атаксию |
|
Пациентам с установленными костными метастазами требуется обследование для оценки безопасности тренировок |
|
Пациентам с хроническими заболеваниями сердца требуется врачебная оценка безопасности тренировок |
|
Одно повторение с максимальным весом (1ПМ)* безопасно для пациентов, прошедших лечение по поводу РМЖ, не имеющих метастазы в кости |
|
Эффективность тренировок с отягощениями |
|
Упражнения с отягощениями могут увеличить мышечную силу пациентов, прошедших лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) |
|
Упражнения с отягощениями могут улучшить качество жизни пациентов, прошедших лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) |
|
Упражнения с отягощениями могут увеличить минеральную плотность костной ткани пациентов, прошедших лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) |
|
Упражнения с отягощениями могут увеличить диапазон движений верхних конечностей пациентов, прошедших лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) |
|
Упражнения с отягощениями снижают риск развития РМЖ-ассоциированной лимфедемы |
|
Упражнения с отягощениями могут уменьшить объем и окружность руки у пациентов с РМЖ-ассоциированной лимфедемой |
|
Обследование перед назначением упражнений с отягощением |
|
Все пациенты, прошедшие лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) должны пройти клиническое обследование перед назначением упражнений с отягощением |
|
Требуется оценить историю заболевания, сопутствующие заболевания, общее состояние здоровья и противопоказания к повышенной физической активности |
|
Требуется оценить риск переломов костей, связанный с гормональной терапией РМЖ |
|
Требуется оценить сердечно-сосудистые риски, связанные с терапией РМЖ. Необходимо провести кардиопульмональное нагрузочное тестирование |
|
Требуется оценить невропатии и нарушения работы опорно-двигательного аппарата, связанные с лечением РМЖ |
|
Требуется оценить выраженность поражения конечности, объем движений |
|
Требуется оценить риск падения пожилых пациентов и пациентов, получивших терапию препаратами с нейротоксическими эффектами (оценка функции ходьбы и равновесия) |
|
Требуется оценить наличие и выраженность рак-ассоциированной усталости |
|
Требуется исходная и периодическая оценка состояния пациента и наличия/выраженности лимфедемы |
|
Правила планирования тренировок |
|
Требуется совместное планирование тренировок специалистом по лечению лимфедемы и пациентом, прошедшим лечение по поводу РМЖ (при наличии лимфедемы или только при риске ее развития) |
|
Требуется учесть уровень исходной физической подготовки пациента и определить реалистичные цели |
|
Требуется выделить достаточное время для восстановления пациента после хирургической операции (до 8 недель) |
|
Упражнения должны быть сфокусированы на конкретных крупных группах мышц туловища, верхнего плечевого пояса, верхних и нижних конечностей |
|
Упражнения необходимо выполнять осторожно, начать с низкой интенсивности и малого числа повторений. |
|
Градация интенсивности упражнений: низкая интенсивность: 55% – 65% 1ПМ (15–20 повторений); умеренная интенсивность: 65% – 75% 1ПМ (8–12 повторений); высокая интенсивность: 75–85% 1ПМ (6–10 повторений) |
|
Если пациент без затруднений поднимает предписанный вес назначенное число повторений, и не отмечается усиление субъективных и/или объективных проявлений лимфедемы, можно увеличить нагрузку. Нагрузку рекомендуется увеличивать с шагом в 5-10%. |
|
Если в тренировках делается перерыв, нужно за каждую 1 неделю пропуска уменьшить уровень нагрузок до того уровня, который был за 2 недели до перерыва (например, 2-недельный перерыв в упражнениях повлечет за собой снижение нагрузок до уровня, используемого 4 недели назад) |
|
Курс тренировок не менее 12 недель. Частота тренировок: 2 – 3 раза в неделю, 2-3 подхода по 8-15 повторений в подходе, перерывы между подходами 2-3 мин. |
|
Рекомендуется в тренировку включить фазы «разогрева» (разминка) и «охлаждения» |
|
Дополнительное оборудование: гантели, эспандеры, утяжелители тренажеров и т. п. |
|
Контроль результат тренировок |
|
Для контроля результатов тренировок и безопасности их проведения используют оценку мышечной силы, выраженности лимфедемы (окружность или объем конечности), выраженности симптомов лимфедемы, объема движения конечности, качества жизни |
|
Во время тренировки необходимо следить за состоянием и ощущениями в конечности (например, появление болей, чрезмерная усталости, покраснения кожи и т. п.) |
|
Показанием к прекращению тренировок и консультации у специалиста является усиление симптомов или объективных проявлений лимфедемы или сохранение дискомфорта/болей в мышцах дольше 48 часов после тренировки |
|
На время тренировок может назначаться компрессионный трикотаж, даже если он не применяется вне тренировок |
1ПМ* - одно повторение с максимальным весом: максимальный вес спортивного снаряда (или вес в спортивном тренажёре), который испытуемый может поднять в одном повторении с полной амплитудой движения для заданного упражнения в одном подходе. 1ПМ используется в качестве верхнего предела для определения нужной нагрузки при выполнении упражнений (в процентах от 1ПМ).
Приложение А 3.5. Виды перевязочных средств для лечения язвы у пациентов с лимфедемой конечности
Виды перевязочных средств для лечения язвы у пациентов с лимфедемой конечности (по материалам раздела по лечению венозных трофических язв рекомендаций МЗ РФ «Варикозное расширение вен нижних конечностей», ID:680) [382,482].
|
Группы повязок |
Фаза раневого процесса |
Степень |
Группы повязок |
|
Суперпоглотители |
1-2 |
Язвы со средней или выраженной экссудацией |
Абсорбируют жидкость, способствуют быстрому очищению раны, стимулируют процессы пролиферации, обладают низкой адгезией. Защищают от вторичного инфицирования. Хорошо сочетаются с эластичной компрессией. |
|
Губчатые повязки |
Паропроницаемы. Активно абсорбируют жидкость, поддерживая сбалансированную влажную среду. |
||
|
Альгинатные повязки |
Стимулируют грануляции, защищают кожу от мацерации. |
||
|
Гидрогели |
2 - 3 |
Язвы с минимальной экссудацией |
Создают и длительно поддерживают влажную среду, прозрачны. |
|
Гидроколлоиды |
2 |
Язвы с малой или средней экссудацией |
Паропроницаемы. Частично проницаемы для воздуха. Абсорбируют жидкость, стимулируют грануляции и эпителизацию, защищают от вторичного инфицирования. |
|
Атравматические сетчатые повязки |
Все фазы |
Хорошо проницаемы, легко моделируются на ранах сложной конфигурации. Не прилипают к ране, защищают грануляции, но требуют дополнительного применения вторичной повязки и средств фиксации. |
|
|
Коллагеновые |
2 - 3 |
Язвы с малой экссудацией |
Легко моделируются на ранах сложной конфигурации. Стимулируют рост и развитие грануляционной ткани. Не нарушают микроциркуляцию и оксигенацию краев язвы. |
|
Биоэквиваленты кожи |
2 - 3 |
Паропроницаемы. Частично проницаемы для воздуха. Способствуют формированию соединительно-тканного матрикса, стимулируют рост грануляций и эпителия, защищают поверхность язвы от вторичного инфицирования. |
Приложение А 3.6. Липосакция: особенности подготовки, проведения и послеоперационного ведения.
Особенности предоперационной подготовки, проведения липосакции и послеоперационного ведения пациента с лимфедемой конечности [98,414,423,424,483].
Предоперационная подготовка к липосакции. С целью минимизации возможных послеоперационных осложнений и достижения максимального эффекта липосакцию следует выполнять только после максимального уменьшения или полного устранения отека конечности при помощи КФПТ. Предоперационный курс КФПТ предпочтительно провести не позднее, чем за 6 месяцев до операции. По завершении предоперационного курса КФПТ обязательно ношение пациентом компрессионного трикотажа, сохраняющего достигнутый результат. Заблаговременно до операции необходимо снять замеры для пошива компрессионного трикотажа плоской вязки по меркам здоровой конечности. Первый комплект необходимо простерилизовать накануне операции. При выявлении отека с ямкой на оперируемой конечности перед вмешательством повторно проводится КФПТ для максимального уменьшения или полного устранения отека.
Особенности техники проведения липосакции:
- Предпочтительнее использовать вибрационную липосакцию, так как плотность ПЖК повышена;
- До операции первый комплект изделий плоской вязки индивидуального пошива по размерам здоровой конечности должен быть уже готов и простерилизован;
- На операционном столе проводится элевация конечности и краткосрочное наложение резинового бандажа для максимального обескровливания конечности;
- На проксимальную часть конечности накладывается манжета и заполняется воздухом до того уровня давления, который будет препятствовать кровотоку;
- Выполняется липосакция на дистальных участках конечности, затем на проксимальных;
- После проведения липосакции на дистальном отделе конечности (предплечье, голень), на нее надевается компрессионный трикотаж до этого уровня;
- Удаляется давящая манжета, липосакция выполняется по тумесцентной технике с введением физиологического раствора и адреналина;
- В процессе операции для достижения максимальной симметричности конечностей и обеспечения эффективности компрессионного трикотажа проводится оценка и сравнение объемов конечностей и оценка объема удаленных тканей;
- После окончания липосакции компрессионный трикотаж надевается на проксимальные участки конечности.
Послеоперационное ведение пациента. Компрессионный трикотаж надевается на оперируемую конечность непосредственно на операционном столе после завершения каждого из этапов липосакции. Наиболее эффективно использовать компрессионный трикотаж плоской вязки индивидуального пошива, такой вариант компрессии сразу после операции позволяет снизить риск возникновения гематом и, за счет низкого давления покоя, снизить риски развития трофических осложнений. Если применение компрессионного трикотажа невозможно сразу после операции, допустимо в течение нескольких суток использовать компрессионные бандажи с последующим переходом на трикотаж плоской вязки. Трикотаж/бандажи должны закрывать все участки конечности, включая пальцы. Для верхней конечности рекомендуется использовать комбинацию рукава и перчатки плоской вязки (первые сутки после операции это может быть перчатка без пальцев) с давлением 20-30 мм.рт.ст., для нижней конечности – колготы на одну ногу + чулок до паха + перчатка на стопу (перчатку целесообразно использовать со 2х суток после операции) плоской вязки с давлением 20-45 мм.рт.ст. Трикотаж должен быть заказан в двух комплектах и меняться первые 1-2 недели раз в 2 суток, потом ежедневно. В дневное время суток на нижней конечности трикотаж носится в два слоя (чулок поверх колгот), на ночь верхний слой снимается. В течение первого года смену трикотажа с необходимой коррекцией замеров требуется проводить через 3, 6, 9 и 12 месяцев. Если после 6-го месяца достигнута стабилизация результатов, смена на 9-м месяце не проводится, а только на 12-м месяце. Потом смена трикотажа (2 комплекта) проводится раз в 6 месяцев. Режим ношения – первый год 24/7, после 12 месяцев под контролем наблюдения врача и дневника замеров у некоторых пациентов возможно ношение трикотажа только в дневное время суток. Трикотаж круглой вязки не удерживает результаты липосакции. Выполнение липосакции без корректной компрессионной терапии в последующем не только приведет к отсутствию желаемой эффективности, но и значительно увеличивает риск осложнений (гематомы, обширные серомы, инфекция).
Приложение А 3.7. Реконструктивные операции: особенности подготовки и послеоперационного ведения.
Особенности предоперационной подготовки и послеоперационного ведения пациента при выполнении реконструктивных операций на лимфатической системе [416,484–489].
Предоперационная подготовка к реконструктивной операции. С целью минимизации возможных послеоперационных осложнений и достижения максимального эффекта реконструктивные операции следует выполнять только после максимального уменьшения или полного устранения отека конечности при помощи КФПТ. Предоперационный курс КФПТ предпочтительно провести не позднее, чем за 6 месяцев до операции. По завершении предоперационного курса КФПТ обязательно ношение пациентом компрессионного трикотажа, сохраняющего достигнутый результат. Заблаговременно необходимо снять замеры для пошива компрессионного трикотажа плоской вязки. До операции необходимо убедиться, что трикотаж пошит правильно, выполняет свои функции, не вызывает осложнений и перемещения отека, так как неправильный градиент и неэффективность трикотажа в послеоперационном периоде может значительно снизить результативность хирургического вмешательства.
Послеоперационное ведение пациента. В раннем послеоперационном периоде рекомендуется либо возвышенное положение конечности (постельный режим + пассивные движения), либо компрессионное бандажирование бинтами низкой степени растяжимости – первые 2-7 дней с последующим переходом к компрессионному трикотажу плоской вязки. Ряд хирургов рекомендует возвышенное положение конечности до 5 дней, так как это время, необходимое для завершения репарационных процессов в интиме соединенных сосудов, и в это время нельзя повышать гидростатическое давление в них, увеличивающееся при опускании конечности. Другие специалисты рекомендуют немедленную компрессию на хирургическом столе бинтами низкой степени растяжимости с целью уменьшить ультрафильтрацию и лимфатическую нагрузку и обеспечить состоятельность клапанного аппарата и ускорение тока лимфы за счет поддержания диаметра лимфатических сосудов в суженном состоянии. Эффективность и безопасность немедленной компрессионной терапии показана в ряде исследований, в том числе в работах Yamamoto T. и Nistor A. Nistor A. в своем послеоперационном протоколе рекомендует наложение бандажей на операционном столе со сменой через 18 часов и последующим круглосуточным нахождением в бандажах со сменой раз в сутки первые 7 дней.
После операции рекомендуется проведение поддерживающей компрессионной терапии с помощью компрессионного трикотажа предпочтительно плоской вязки как минимум 6 месяцев после операции (первые 3 месяца целесообразно круглосуточное ношение компрессионного трикотажа с переходом в последующие три месяца на дневное ношение). После первых 6 месяцев можно снижать количество часов в компрессионном трикотаже под контролем замеров при условии отсутствия возврата отека. Режим и длительность применения компрессии определяет врач, проводящий наблюдение и лечение пациента после операции. В отсутствие проявлений лимфедемы после операции целесообразно профилактическое применение компрессионного трикотажа при физических нагрузках, перелетах.
В течение 4 недель после операции не рекомендуется применение для оперированной конечности активных методов консервативного лечения (ручной лимфодренажный массаж, аппаратная пневмокомпрессия и т.п.).
Приложение Б. Алгоритмы действий врача
Алгоритм ведения пациента с лимфедемой конечности или группы риска ее развития (на основе Международного консенсусного документа «Lymphoedema Framework. Best Practice for the Management of Lymphoedema. International consensus») [78]
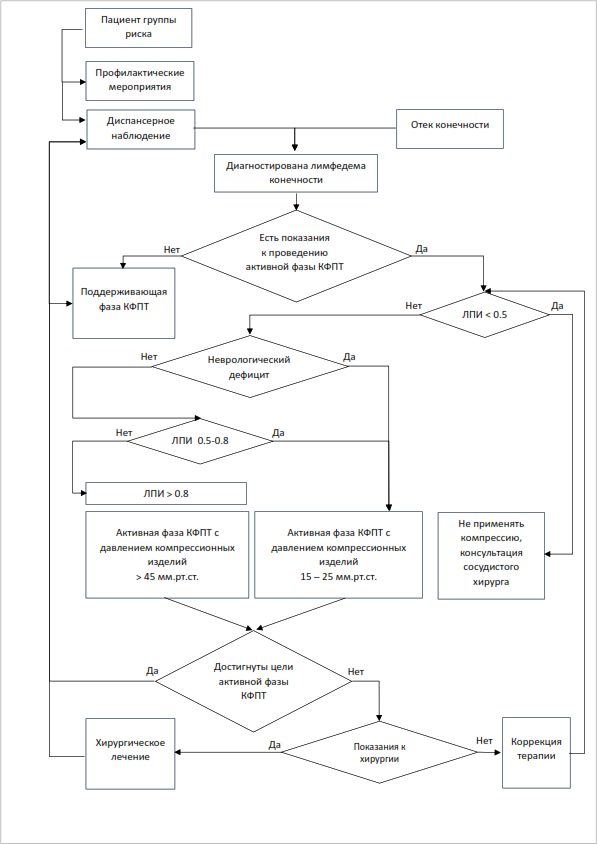
Приложение В. Информация для пациентов
Лимфа. Это прозрачная жидкость, содержащая в основном белок и лейкоциты (клетки крови, которые борются с инфекцией). Лимфатические сосуды отводят лимфатическую жидкость от тканей и органов организма. Жидкость фильтруется через лимфатические узлы (также называемые железами) и, в итоге, попадает в кровоток.
Лимфедема. Это отек, вызванный скоплением жидкости, соединительной ткани и жира, который чаще всего возникает на руках, ногах или в других частях тела в результате нарушения транспортной функции лимфатической системы.
В организме есть сеть сосудов, называемая лимфатической системой. Лимфатические узлы являются частью этой системы. Лимфатическая система аналогична системе кровеносных сосудов, но вместо крови она несет лимфу. Лимфедема возникает при нарушении тока лимфы в лимфатической системе.
Кто заболевает лимфедемой? Причиной развития лимфедемы могут быть как врожденные (первичная лимфедема) так и приобретённые (вторичная лимфедема) нарушения транспорта лимфы. Причины развития заболевания нужно искать совместно с врачом.
Каковы симптомы лимфедемы? Наиболее распространенные:
- отек конечности;
- ощущение стеснения или тяжести в пораженной конечности;
- проблемы с движением пораженной конечности.
В некоторых случаях эти симптомы развиваются до появления заметного отека. Как можно скорее сообщите врачу при появлении каких-либо из этих симптомов: распознавание и лечение лимфедемы на ранних стадиях может помочь предотвратить их прогрессирование с течением времени и уменьшить их тяжесть. Имейте в виду, что симптомы могут развиваться очень медленно.
Как диагностируется лимфедема? Диагноз выставляет врач на основе осмотра и сбора анамнеза. Важной частью обследования является в том числе измерение объема пораженной конечности. Врач или медсестра измеряют окружность конечности в нескольких местах. Необходимо наблюдать за конечностями в соответствии с указаниями врача.
Как лечиться лимфедема? Лечение следует начинать как можно раньше. Перед началом терапии лимфедемы необходимо исключить другие причины отека конечностей, такие как тромбоз глубоких вен или рецидив рака (при вторичной лимфедеме). Лекарства от лимфедемы нет, но есть методы лечения, которые могут помочь уменьшить отек и сделать жизнь более комфортной. Эти методы работают лучше всего, если начаты на самой ранней стадии болезни, поэтому обратитесь к врачу сразу же, как только заметите какой-либо отек. Лучше всего обращаться в клиники, в которых есть специалисты, имеющие опыт лечения лимфедемы.
Лечение может включать:
- Физические упражнения. Они могут помочь предотвратить рост лимфедемы. Во время физических упражнений люди с лимфедемой всегда должны носить компрессионные изделия.
- Компрессионное бандажирование. Это особый вид бинтования разными материалами в несколько слоев, при котором на область отека оказывается мягкое постоянное давление.
- Компрессионный трикотаж (рукава или чулочно-носочные изделия). Очень похожи на компрессионные повязки, оказывают мягкое постоянное давление на пораженную конечность, чтобы уменьшить отек.
- Ручной лимфодренаж. При этой процедуре специалист особым образом массирует конечность, чтобы помочь вывести скопившуюся жидкость.
- Хирургическая операция. При тяжелых формах лимфедемы врач может предложить операцию. Важно понимать, что хирургическая операция не заменяет и не отменяет компрессионную терапию!
Существует несколько хирургических процедур, которые могут помочь в лечении лимфедемы в определенных ситуациях:
- Пересадка (трансплантация) лимфатических узлов — это операция, при которой здоровые лимфатические узлы удаляются из одной области тела и пересаживаются на конечность с лимфедемой. Эти лимфатические узлы могут компенсировать лимфатическую циркуляцию конечности и улучшить состояние конечности.
- Лимфовенозное шунтирование – это операция, в ходе которой лимфатические сосуды соединяются с мелкими соседними венами, минуя область, где лимфатические сосуды были повреждены.
Эти два типа процедур наиболее полезны на ранней стадии развития лимфедемы и требуют консультации с квалифицированным и опытным лимфатическим хирургом.
- Липосакция – это процедура, при которой из конечности с лимфатическим отеком удаляют лишнюю жировую ткань с помощью канюли (тонкой трубки). Эта процедура наиболее полезна для людей с запущенными заболеваниями, у которых в конечностях откладывается большое количество фиброзной ткани и лишнего жира.
Врач может обсудить с вами возможные варианты лечения в зависимости от индивидуальной ситуации.
Профилактика осложнений если у Вас есть лимфедема. Во избежание травм и/или повреждений пораженной конечности:
- Держите кожу в чистоте. Каждый день проводите гигиенические процедуры мягким мылом.
- Будьте осторожны с ногтями. Не повреждайте кожу вокруг ногтей и не срезайте кутикулыу.
- Используйте питательные мази, чтобы кожа не высыхала и не трескалась.
- Для бритья используйте электрическую бритву вместо лезвия.
- Всегда пользуйтесь солнцезащитным кремом, когда выходите на улицу.
- Если поражена рука, надевайте перчатки, когда работаете в саду, готовите или занимаетесь чем-то, что может повредить коже.
- Если поражена нога, на улице носите обувь с твердой подошвой.
- Если у Вас небольшой порез, царапина или укус на руке или ноге, хорошо промойте их водой с мылом. Затем используйте крем с антибиотиком (например, с гарамицином). Обратитесь к врачу, если рана не заживает быстро или если у Вас есть признаки инфекции.
- По возможности избегайте инъекций, забора крови или установки внутривенных катетеров в конечность с лимфедемой. Избегайте других процедур, при которых прокалывают кожу (иглоукалывание, нанесение татуировок).
- Избегайте саун, паровых бань и джакузи.
Дополнительные правила:
- Не носите одежду, которая препятствует оттоку лимфы к конечности и от нее, и избегайте деятельности, которая может помешать оттоку лимфы (например, использование тазового пояса при скалолазании может затруднить отток лимфы от нижней конечности).
- Носите компрессионное белье (специальные рукава или чулки), чтобы уменьшить отек. Компрессионный трикотаж, который сшит по индивидуальному размеру, наиболее эффективен.
- Держите вес под контролем. Чрезмерное увеличение веса может усугубить лимфедему и снизить эффективность компрессионного белья.
- Посетите специалиста по лечению лимфедемы. Они обучены специальным видам лечения, которые помогут улучшить состояние.
- Старайтесь выполнять аэробные упражнения. Доказано, что эти занятия уменьшают выраженность лимфедемы, улучшают общую физическую форму и помогают контролировать вес. Даже легкие формы физической активности (например, ходьба) полезны для здоровья.
- Избегайте контроля артериального давления на пораженной руке. Артериальное давление можно измерить на противоположной руке или, если поражены обе руки, на ноге.
Следует дополнительно обратиться к врачу, если:
- Увеличился отек.
- Появилось покраснение (красные пятна или полосы).
- Пораженная конечность покрылась волдырями или сыпью.
- Пораженная конечность болезненная или теплая на ощупь.
- Температура тела выше 38°C, и это не связано с простудой или другим заболеванием.
Эти симптомы могут сигнализировать о возможной инфекции, которая может усугубить течение лимфедемы.
Влияние лимфедемы на жизнь человека. Хотя лимфедема обычно не является опасным для жизни состоянием, она может серьезно повлиять на качество жизни. Изменение внешнего вида конечности может быть как неприятным, так и болезненным.
- Лимфедема может замедлить заживление тканей и иногда вызывает хроническую боль.
- В конечности с лимфедемой может развиться целлюлит, кожная инфекция, требующая лечения антибиотиками и возможной госпитализации.
- После операции по поводу рака молочной железы отекшая или деформированная рука может вызывать тревогу и депрессию.
- Если лимфедема влияет на способность нормально управлять рукой или ногой, это может снизить качество жизни и мобильность пациента.
Если у вас развилась лимфедема или есть подозрение на нее - немедленно обратитесь к врачу.
Содержание
- Российские клинические рекомендации по диагностике и лечению лимфедемы конечностей
- Список сокращений
- Термины и определения
- 1. Краткая информация
- 1.1. Определение заболевания или состояния (группы заболеваний или состояний)
- 1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
- 1.2.1. Патогенез лимфедемы
- 1.2.2. Первичная лимфедема.
- 1.2.3. Вторичная лимфедема
- 1.2.3.1. Злокачественная лимфедема.
- 1.2.3.2. Лимфедема, связанная с диагностикой и лечением рака.
- 1.2.3.3. Инфекция
- 1.2.3.4. Ожирение
- 1.2.3.5. Травма
- 1.2.3.6. Лимфедема, ассоциированная с медицинскими вмешательствами, не связанными с лечением рака
- 1.2.3.7. Системные воспалительные заболевания
- 1.2.3.8. Хроническая венозная недостаточность
- 1.2.3.9. Филяриоз (филяриатоз)
- 1.2.3.10. Другие факторы развития вторичной лимфедемы.
- 1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
- 1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- 1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
- 1.6. Клиническая картина заболевания и состояния (группы заболеваний или состояний)
- 2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
- 2.1. Критерии установления диагноза (состояния)
- 2.2. Диагностика; общие положения
- 2.3. Жалобы и анамнез
- 2.4. Клиническое обследование
- 2.5. Лабораторная диагностика
- 2.6. Генетическая диагностика
- 2.7. Инструментальная диагностика
- 2.7.1. Общие положения
- 2.7.2. Методы инструментальной диагностики
- 2.7.2.1. Ультразвуковое исследование.
- 2.7.2.2. Лимфография цветная
- 2.7.2.3. Лимфография флуоресцентная (ICG-лимфография, NIR-лимфография)
- 2.7.2.4. Лимфография рентгеновская (рентгенолимфография)
- 2.7.2.5. Рентгеноденситометрия
- 2.7.2.6. Лимфосцинтиграфия
- 2.7.2.7. Компьютерная томография (рентгеновская)
- 2.7.2.8. Магнитно-резонансная лимфография бесконтрастная (бесконтрастная МР-лимфография)
- 2.7.2.9. Магнитно-резонансная лимфография контрастная (контрастная МР-лимфография)
- 2.7.2.10. Биоимпеданс
- 2.7.2.11. Изображение с 3D-камеры (3D-визуализация).
- 2.8. Дифференциальная диагностика лимфедемы и отеков иного происхождения
- 3. Лечение, включая медикаментозную и немедикаментозную терапию
- 3.1. Цели лечения лимфедемы
- 3.2. Общие положения, принципы и тактика лечения лимфедемы
- 3.3. Консервативное лечение лимфедемы
- 3.3.1. КФПТ: эффективность
- 3.3.1.1. Цели консервативной терапии лимфедемы, КФПТ.
- 3.3.1.2. Устранение или уменьшение лимфатического отека
- 3.3.1.3. Профилактика прогрессирования лимфедемы
- 3.3.1.4. Устранение или уменьшение субъективных симптомов лимфедемы
- 3.3.1.5. Профилактика или лечение поражений кожи и ПЖК
- 3.3.1.6. Повышение качества жизни
- 3.3.2. КФПТ: компоненты
- 3.3.3. КФПТ: фазы
- 3.3.4. КФПТ: особенности при активном раке.
- 3.3.5. КФПТ: противопоказания
- 3.3.6. КФПТ: МЛД (мануальный лимфодренаж) и СЛД (самостоятельный лимфодренаж)
- 3.3.7. КФПТ: компрессионная терапия
- 3.3.7.1. Компрессионная терапия: общие положения и цели
- 3.3.7.2. КМБ (компрессионное многослойное бандажирование); общие положения
- 3.3.7.3. КМБ: технические особенности
- 3.3.7.4. КМБ: вовлеченность пациента
- 3.3.7.5. Компрессионный трикотаж
- 3.3.7.6. РКС: регулируемые компрессионные системы
- 3.3.7.7. Компрессионная терапия: противопоказания
- 3.3.8. КФПТ: ЛФК, физические упражнения
- 3.3.9. КФПТ: уход за кожей. Лечение трофических дефектов кожи и ПЖК
- 3.3.10. Контроль массы тела
- 3.3.11. Дополнительные методы консервативного лечения лимфедемы
- 3.3.12. Фармакотерапия в лечении лимфедемы конечностей
- 3.3.13. Перспективные методы лечения лимфедемы
- 3.3.1. КФПТ: эффективность
- 3.4. Хирургическое лечение лимфедемы
- 3.4.1. Цели, показания и общие условия проведения хирургического лечения
- 3.4.2. Типы хирургических вмешательств при лимфедеме.
- 3.4.3. Редукционные операции при лимфедеме конечностей.
- 3.4.4. Реконструктивные операции при лимфедеме конечностей.
- 3.4.5. Комбинированные вмешательства при лимфедеме конечности
- 4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- 5.1. Диспансерное наблюдение, ранняя диагностика и профилактика прогрессирования лимфедемы
- 5.2. Профилактика развития вторичной лимфедемы.
- 5.2.1. Группы риска
- 5.2.2. Консервативная профилактика развития вторичной лимфедемы
- 5.2.2.1. Информирование пациента, самоконтроль и профилактика вторичной лимфедемы
- 5.2.2.2. Поведенческая профилактика РМЖ-ассоциированной лимфедемы
- 5.2.2.3. Компрессионная терапия и профилактика вторичной лимфедемы
- 5.2.2.4. Экстремальная температура и профилактика вторичной лимфедемы
- 5.2.2.5. Сауны, паровые бани или джакузи и профилактика вторичной лимфедемы
- 5.2.2.6. Снижение веса, контроль веса и профилактика вторичной лимфедемы
- 5.2.2.7. ЛФК, физические нагрузки и профилактика вторичной лимфедемы
- 5.2.3. Хирургическая профилактика развития вторичной лимфедемы
- 6. Организация оказания медицинской помощи
- 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
- Приложение А 3.1. Дифференциальная диагностика лимфедемы, липедемы и ожирения
- Приложение А 3.2. Основные компоненты компрессионного многослойного бандажа (КМБ) [78]
- Приложение А 3.3. Протокол ежедневного ухода за кожей конечности с лимфедемой
- Приложение А 3.4. Рекомендации по ЛФК для пациентов перенесших хирургическое вмешательство в зоне лимфатических путей конечности
- Приложение А 3.5. Виды перевязочных средств для лечения язвы у пациентов с лимфедемой конечности
- Приложение А 3.6. Липосакция: особенности подготовки, проведения и послеоперационного ведения.
- Приложение А 3.7. Реконструктивные операции: особенности подготовки и послеоперационного ведения.
- Приложение Б. Алгоритмы действий врача
- Приложение В. Информация для пациентов