- Рекоммендации АФР online
- Флебит и тромбофлебит поверхностных сосудов. АФР, 2_2021
Рекомендации АФР online
Поиск по разделу
Рекомендации утратили силу
Общероссийская общественная организация "Ассоциация флебологов России" (АФР) информирует о том, что клинические рекомендации "Флебит и тромбофлебит поверхностных сосудов", версия 2_2021 г., ID КР668_1 утратили свою силу.
Актуальные рекомендации размещены в начале раздела "Рекомендации АФР online" https://phlebounion.ru/recommendations и снабжены пометкой "Действующие рекомендации с навигацией"
Клинические рекомендации
Флебит и тромбофлебит поверхностных сосудов
Справочная (расширенная) версия
Код версии (ID): 2_2021
ID минздрава: КР668_1
МКБ 10: I80.0, I80.8, I82.1, O22.2, O87.0
Профессиональные ассоциации: Ассоциация флебологов России; Ассоциация сердечно-сосудистых
хирургов России; Российское общество хирургов; Российское общество ангиологов и сосудистых хирургов.
Год утверждения (частота пересмотра): 2021 (пересмотр каждые 3 года)
Возрастная категория: Взрослые
Текст в pdf
Скачать текст рекомендаций в формате pdf
Рекомендации на сайте Министерства здравоохранения Российской Федерации
Список сокращений
АВК – антагонисты витамина К
АКТ – антикоагулянтная терапия
АСК** – ацетилсалициловая кислота**
АТIII – антитромбин III
АФС – антифосфолипидный синдром
БПВ – большая подкожная вена
ВТЭО - венозные тромбоэмболические осложнения
ГТ – гнойный тромбофлебит
ДСВНК – дуплексное сканирование вен нижних конечностей
ИМТ – индекс массы тела
МПВ – малая подкожная вена
НМГ – низкомолекулярные гепарины (АТХ группа: B01AB Группа гепарина)
ОР - относительный риск
НПВП – нестероидные противовоспалительные препараты
п/к - подкожно
ПОАК – прямые оральные антикоагулянты (АТХ группа: B01AF Прямые ингибиторы фактора Ха; B01AE Прямые ингибиторы тромбина)
ПТБ – посттромботическая болезнь
РОАГ – Российское общество акушеров-гинекологов
СКФ – скорость клубочковой фильтрации
сОР – скорректированный относительный риск (adjusted hazards ratio)
СПС – сафено-поплитеальное соустье
СФС – сафено-феморальное соустье
ТГВ – тромбоз глубоких вен
ТНПВ – тромбоз неварикозных поверхностных вен
ТФПВ – тромбофлебит поверхностных вен
ТЭЛА – тромбоэмболия легочных артерий
ХЗВ – хронические заболевания вен
ASH - American Society of Hematology
NCCN (National Comprehensive Cancer Network) - Национальная онкологическая сеть, США.
PICC (Peripherally Inserted Central Catheter) – периферически имплантируемый центральный венозный катетер
RCOG - Royal College of Obstetricians and Gynaecologist
Термины и определения
Варикозное расширение подкожных вен (варикозная трансформация подкожных вен) - подкожные расширенные вены диаметром более 3 мм в положении стоя. Обычно имеют узловатый (мешковидный) и/или извитой (змеевидный) вид.
Варикотромбофлебит – тромбофлебит (тромбоз) варикозно измененных поверхностных вен.
Дуплексное сканирование вен нижних конечностей - метод ультразвукового исследования вен, при котором, в случае необходимости, возможно одновременное использование двух или трех режимов сканирования.
Кроссэктомия (операция Троянова-Тренделенбурга) - высокая (сразу у глубокой магистрали) перевязка большой (или малой) подкожной вены с обязательным лигированием всех приустьевых притоков и иссечением ствола поверхностной вены в пределах операционной раны.
Приустьевая перевязка (высокое лигирование) - высокая (сразу у глубокой магистрали) перевязка большой (или малой) подкожной вены без лигирования приустьевых притоков и иссечения ствола поверхностной вены в пределах операционной раны.
Тромбофлебит поверхностных вен (тромбоз поверхностных вен) - патологическое состояние, при котором происходит формирование тромботических масс в поверхностных венах с развитием сопутствующей воспалительной реакции венозной стенки, подкожной клетчатки и кожи.
Тромбоэмболия легочной артерии (ТЭЛА) - острый жизнеугрожающий синдром, характеризующийся закупоркой ветвей легочной артерии тромбом и рядом патофизиологических реакций, выраженность которых находится в зависимости от объема тромботической окклюзии (в значении масштаба, общего объема эмболических масс, размера тромбоэмболического поражения), компенсаторных возможностей правого желудочка сердца и тяжести фоновых заболеваний.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.0. Определение заболевания или состояния (группы заболеваний или состояний)
Тромбоз/тромбофлебит поверхностных вен - патологическое состояние, при котором происходит формирование тромботических масс в поверхностных венах с развитием сопутствующей воспалительной реакции кожи и подкожной клетчатки.
1.1. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Тромботический и сопутствующий воспалительный процесс может поражать не только варикозно измененные, но и неварикозные вены. В связи с этим важно выделение тромбоза варикозно измененных поверхностных вен (варикотромбофлебит) и тромбоза неварикозных поверхностных вен (ТНПВ). Прогноз заболевания и тактика лечения пациентов в этих случаях имеют существенные различия. Самым частым фактором риска ТФПВ служит наличие варикозно расширенных вен нижних конечностей. Трансформацию поверхностных вен у пациентов с ТФПВ выявляют с частотой до 80%, с другой стороны, ТФПВ развивается у 4-59% пациентов с варикозной болезнью [1–5]. В России, по данным исследования СПЕКТР, частота развития ТФПВ у пациентов с ХЗВ составила 7% [6]. Среди возможных факторов риска ТФПВ называют возраст, ожирение, употребление табака, ТГВ или ТФПВ в анамнезе, беременность и послеродовый период, прием гормональных пероральных контрацептивов, заместительную гормонотерапию, иммобилизацию, недавние операции и травмы, онкологические заболевания [3]. Так, например, в течение первого месяца после родов риск развития ТФПВ существенно повышается [7]. Онкологическое заболевание удается обнаружить у 10-18% больных с ТФПВ [8–10]. Тромбофилия наследственного характера, в частности мутация гена V фактора свертывания типа Лейден, мутация в гене протромбина G20210A, дефицит антитромбина III (AT III), протеина С и S значительно увеличивают риск развития ТФПВ [11–21]. В отсутствие варикозно расширенных вен, аутоиммунных заболеваний и онкологической патологии, мутация Лейдена увеличивает риск ТФПВ примерно в 6 раз, мутация в гене протромбина G20210A – в 4 раза, комбинированные варианты в 12,9 раз [16]. Среди пациентов с ТФПВ распространенность различных нарушений в системе гемостаза (резистентность к активированному протеину С и дефицит антитромбина III, протеина С или протеина S) достигает 59% [15]. У пациентов с тромботическим поражением варикозно расширенных вен особую роль играет дислипидемия, повышающая риск развития повторного ТФПВ в 5,4 раз [13]. Возможным фактором риска ТФПВ могут быть аутоиммунные заболевания, сопровождающиеся повышением уровня антител к кардиолипину. У пациентов с рецидивирующим ТФПВ в 33,3% случаев выявляют повышенный уровень антител к кардиолипину [22]. Наиболее опасными осложнениями ТФПВ являются распространение тромба на глубокие вены (тромбоз глубоких вен) и развитие ТЭЛА. Частота тромбоза глубоких вен достигает 18,1% (95% ДИ: 13.9%, 23.3%), частота развития симптоматической ТЭЛА при ТФПВ составляет 6.9% (95% ДИ: 3.9%, 11.8%) [23]. Важно учитывать риск распространения ТФПВ в глубокую венозную систему, который составляет от 7% до 32% [2,3,24]. Наиболее часто ТФПВ распространяется в глубокие вены через СФС [24][25]. Считается, что чем ближе проксимальный уровень тромба в поверхностной вене к соустью, тем выше риск перехода процесса в глубокие вены, а расположение в пределах 1 см от зоны соустья связано с наибольшим риском [26]. Между тем, на сегодняшний день нет убедительных данных, позволяющих утверждать, что при ТФПВ основным источником ТЭЛА является тромбоз с локализацией в области соустья. В одном исследовании показано, что ТФПВ в пределах 3 см от СФС не повышает вероятность развития легочной эмболии [27]. В качестве источника ТЭЛА у пациента с ТФПВ может быть симультанный тромбоз глубоких вен, в том числе контралатеральной конечности [28].
1.2. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В популяционном исследовании 2014 г. ежегодная заболеваемость ТФПВ в когорте 265 687 человек составила 0,64% (95%ДИ 0,55%-0,74%) [29]. При этом заболеваемость была несколько выше у женщин, чем у мужчин и повышалась с возрастом для обоих полов. В частности, показатель ежегодной заболеваемости ТФПВ у женщин в возрасте 18 – 39 лет составил 0,13% (95%ДИ 0,02–0,23), в возрасте >75 лет 2,19% (95%ДИ 1,59%–2,78%); у мужчин в таких же возрастных группах этот показатель составил 0,04% (95%ДИ, 0,00–0,1) и 0,95% (95% ДИ, 0,41–1,48). Сопутствующий симптоматический тромбоз глубоких вен был диагностирован в этом исследовании у 24,6% пациентов с ТФПВ (95%ДИ 18,3%-31,7%), а симптоматическая ТЭЛА у 4,7% (95% ДИ 2,0%-9,0%). В более раннем популяционном исследовании от 1973 г. ежегодная заболеваемость ТФПВ у женщин в возрасте 20 – 39 лет составила 0,31% – 0,51%, в возрасте старше 70 лет 2,2% [30]. У мужчин в таких же возрастных группах этот показатель составил 0,05% - 0,13% и 1,6% - 1,8% соответственно. В США частоту ТФПВ оценивают в 1 случай на 1000 человек населения в год (0,1%), ежегодно регистрируют 125,000 случаев ТФПВ [31]. Средний возраст больных в ТФПВ колеблется от 54 до 65 лет, при этом, заболевание чаще поражает женщин [32,33]. Истинная распространенность заболевания может превышать приведенные цифры в связи с тем, что многие пациенты с ограниченными вариантами ТФПВ не обращаются за врачебной помощью.
1.3. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Флебит и тромбофлебит (I80):
- I80.0 - Флебит и тромбофлебит поверхностных сосудов нижних конечностей.
- I80.8 - Флебит и тромбофлебит других локализаций
Эмболия и тромбоз других вен (I82):
- I82.1 - Тромбофлебит мигрирующий
Венозные осложнения во время беременности (О22):
- О22.2 - Поверхностный тромбофлебит во время беременности
Венозные осложнения в послеродовом периоде (О87):
- О87.0 - Поверхностный тромбофлебит в послеродовом периоде
1.4. Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация ТФПВ включает деление по стадиям (в зависимости от фазы течения и проявлений воспалительной реакции) и по степени риска перехода тромба на глубокие вены.
1.4.1. ТФПВ и посттромботические изменения
- При формулировке диагноза рекомендуется разделять ТФПВ и посттромботические изменения в поверхностных венах
Термин «посттромботические изменения поверхностных вен» может применяться для обозначения в диагнозе состояния после перенесенного тромбофлебита (когда не требуется лечение или наблюдение), для описания клинических проявлений перенесенного ТФПВ (уплотнения, пигментации в зоне расположения измененных вен), а также для описания изменений в венах при ультразвуковом исследовании. В случае посттромботических изменений не требуется указание стадии ТФПВ и степени риска перехода тромба на глубокие вены. Условной границей разграничения стихшего тромбофлебита и посттромботических изменений является 45 суток.
Локальные уплотнения в зоне расположения посттромботически измененных поверхностных вен и их посттромботические изменения при ДСВНК могут сохраняться на протяжении длительного времени (6 мес. и более), но не требуют лечения и наблюдения.
1.4.2. Стадии ТФПВ в зависимости от фазы течения и проявлений воспалительной реакции:
- При формулировке диагноза пациента с ТФПВ рекомендуется использовать следующее деление ТФПВ на стадии: острый, стихающий, стихший
С тактической точки зрения необходимо разделение ТФПВ на стадии в зависимости от активности и динамики проявлений воспалительной реакции и давности от начала тромбоза. Стадия ТФПВ влияет на: необходимость госпитализации, выбор цели и вида хирургического вмешательства, определение показаний к применению антикоагулянтов (препаратов из группы АХТ: антитромботические средства), определение показаний к применению НПВП. Стадии ТФПВ:
- острый ТФПВ (0-7 дней от момента начала заболевания), обычно сопровождается выраженными проявлениями воспаления кожи и мягких тканей около пораженных сосудов;
- стихающий ТФПВ (1-3 недели от момента начала заболевания), характеризуется регрессом проявлений воспаления мягких тканей около пораженных сосудов;
- стихший ТФПВ (более 3-х недель от момента начала заболевания) характеризуется отсутствием проявлений воспаления мягких тканей, но сохранением безболезненных или слабо болезненных уплотнений по ходу пораженных сосудов, а также возможным наличием гиперпигментации кожи над ними.
Стадией "стихшего тромбофлебита" обозначается период, в который отсутствуют или слабо выражены клинические проявления воспаления и не требуется симптоматическая терапия, но сохраняется повышенный риск рецидива венозного тромбоза и может быть целесообразна антикоагулянтная терапия. Разделение на указанные выше стадии носит условный характер. Решение о том, в какой стадии находится процесс, не следует основывать только на сроках заболевания. Это решение принимает лечащий специалист с учетом выраженности и динамики воспаления у данного пациента.
1.4.3. Степень риска перехода тромба на глубокие вены
- При формулировке диагноза пациента с ТФПВ рекомендуется использовать следующую градацию риска перехода тромба на глубокие вены: низкий, умеренный, высокий
С тактической точки зрения необходимо разделение пациентов с ТФПВ на группы по степени риска перехода тромба на глубокие вены. Степень риска перехода тромба на глубокие вены влияет на: необходимость госпитализации (с учетом стадии ТФПВ), необходимость назначения и дозировку антикоагулянтов (АХТ: антитромботические средства), показания к хирургическому вмешательству с учетом стадии ТФПВ и степени риска перехода тромба на глубокие вены. Степень риска определяется протяженностью тромботического процесса, локализацией проксимальной границы тромбоза, наличием или отсутствием варикозной трансформации подкожных вен [33–36].
Низкий риск перехода тромба на глубокие вены:
- изолированный тромбофлебит варикозных и неварикозных притоков магистральных поверхностных вен;
Умеренный риск перехода тромба на глубокие вены:
- тромбофлебит ствола магистральной подкожной вены или приустьевых притоков с проксимальной границей тромба дистальнее 3 см от соустья (передняя добавочная подкожная вена может рассматриваться как магистральная);
- тромбоз надфасциального сегмента перфорантной вены до уровня фасции;
Высокий риск перехода тромба на глубокие вены:
- тромбофлебит магистральной поверхностной вены любой протяженности с проксимальной границей тромба на расстоянии 3 см от соустья или ближе.
Не существует данных, позволяющих оценить зависимость степени риска перехода тромба на глубокие вены от стадии ТФПВ (активности воспалительного процесса). При этом доказано, что даже при полном стихании клинических проявлений и лабораторных маркеров воспаления риск рецидива венозного тромбоза и развития ТЭЛА выше популяционного риска первого тромботического события. Риск рецидива ВТЭО максимален в течение 3-х месяцев (сОР 71.4 (95% ДИ, 60.2-84.7) и остается повышенным в течение нескольких лет после эпизода ТФПВ (через 5 лет сОР 5.1 (95% ДИ 4.6-5.5)) [37]. Не требуется указание степени риска перехода тромба на глубокие вены и стадии ТФПВ в случае наличия посттромботических изменений поверхностных вен.
- К дополнительным факторам риска ВТЭО, ассоциированным с увеличенной вероятностью выявления ТГВ/ТЭЛА на момент диагностики ТФПВ, рекомендуется относить: мужской пол, личный или семейный анамнез ВТЭО, возраст старше 75 лет, наличие неизлеченного рака, наличие системного воспалительного заболевания, госпитализацию пациента, тромбоз неварикозных вен [36].
- К дополнительным факторам риска рецидива ТФПВ или его прогрессирования с развитием ТГВ/ТЭЛА в течение 3 мес после диагностики рекомендуется относить: мужской пол, личный или семейный анамнез ВТЭО, рак в анамнезе, стационарное лечение, тромбоз неварикозных вен, давность симптомов менее 7 суток, тяжелую форму венозной недостаточности, избыточную массу тела [33,36,38,39].
1.4.4. Формулировка диагноза
- При формулировке диагноза пациента с ТФПВ рекомендуется использовать деление ТФПВ на стадии и указывать степень риска перехода тромба на глубокие вены.
Не существует общепринятой классификации для ТФПВ. Однако, при формулировке диагноза следует отразить наиболее важные особенности патологического процесса, имеющие значение для определения тактики лечения:
- локализация;
- поражены варикозно измененные или неварикозные вены;
- вовлеченность в патологический процесс магистральных поверхностных вен (стволов большой и малой подкожных вен);
- проксимальная граница поражения;
- имеется ли переход в глубокую венозную систему;
- какова длительность существования тромбофлебита (уместно указание ориентировочной даты или периода времени начала тромбофлебита);
- стадия ТФПВ и динамика проявлений воспаления.
При наличии соответствующей информации целесообразно указывать состояние просвета вен в зоне поражения: полная, неполная реканализация или отсутствие реканализации. Длительное отсутствие реканализации может быть описано в диагнозе как хроническая посттромботическая окклюзия поверхностной вены
Примеры формулировки диагноза пациента с ТФПВ и посттромботическими изменениями в поверхностных венах:
- Острый варикотромбофлебит притоков и ствола БПВ до сафено-феморального соустья, без перехода на бедренную вену от 01.01.2019 г., высокий риск перехода тромба на глубокие вены;
- Стихающий тромбофлебит варикозных притоков и ствола БПВ с переходом через СФС на бедренную вену на протяжении 2 см, от 01.01.2019 г.; отсутствие реканализации;
- Стихший тромбофлебит неварикозных притоков и ствола БПВ до 3 см от сафено-феморального соустья; неполная реканализация; высокий риск перехода тромба на глубокие вены;
- Стихающий тромбофлебит неварикозных притоков БПВ в средней и верхней трети голени без перехода на ствол, низкий риск перехода тромба на глубокие вены;
- Острый варикотромбофлебит притоков и ствола МПВ до сафено-поплитеального соустья, без перехода на подколенную вену, высокий риск перехода тромба на глубокие вены;
- Стихающий варикотромбофлебит притоков и ствола МПВ до 5 см от сафено-поплитеального соустья, умеренный риск перехода тромба на глубокие вены;
- Состояние после ТФПВ. Хроническая посттромботическая окклюзия притоков БПВ левой голени.
- Состояние после ТФПВ. Посттромботические изменения в поверхностных венах, неполная реканализация варикозных притоков БПВ правой нижней конечности.
- При произошедшем переходе тромба на глубокие вены или выявленном симультанном ТГВ рекомендуется формулировать и кодировать диагноз как "тромбоз глубоких вен" (ТГВ), исходя из клинически более значимого заболевания.
1.5. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина при флебите и тромбофлебите поверхностных сосудов определяется наличием локального воспаления в ограниченном сегменте поверхностного сосуда с характерными субъективными симптомами воспаления (боль, общее недомогание, субфебрильное повышение температуры) и его объективными проявлениями (местная гиперемия кожи, отек, болезненное уплотнение по ходу воспаленного сосудистого сегмента).
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
2.0. Критерии установления диагноза/состояния
Критерием постановки диагноза тромбофлебита поверхностных вен является сочетание признаков воспаления мягких тканей при опросе и физикальном обследовании пациента и признаков тромботической окклюзии поверхностной вены в зоне воспаления при ультразвуковом исследовании. При отсутствии возможности выполнения ультразвукового исследования критерием постановки диагноза является выявление признаков воспаления в проекции крупных подкожных вен и их притоков. В стадию стихшего тромбофлебита критерием постановки диагноза является выявление признаков перенесенного тромбофлебита при физикальном обследовании и/или выявление признаков тромботической окклюзии поверхностной вены при ультразвуковом исследовании.
2.1. Жалобы и анамнез
В зависимости от локализации тромботического процесса, его распространенности, длительности заболевании и степени вовлечения в воспалительный процесс окружающих пораженную вену тканей могут наблюдаться различные варианты клинических проявлений заболевания — от резко выраженного воспаления по ходу тромбированной вены, сопровождающегося нарушениями общего состояния больного, до незначительных проявлений, как местного, так и системного характера.
- При подозрении на ТФПВ рекомендуется оценить наличие и выраженность следующих субъективных и объективных симптомов: боль по ходу тромбированных вен; гиперемия по ходу тромбированных вен; общая гипертермия; недомогание, озноб.
УДД 4 УУР С [5,25,40–43]
Комментарий. Описанные симптомы не исследованы в отношении чувствительности и специфичности.
2.2. Физикальное обследование
- При подозрении на ТФПВ рекомендуется оценить путем пальпации нижних конечностей наличие и выраженность следующих объективных признаков: шнуровидный, плотный, резко болезненный тяж или уплотненные варикозные узлы по ходу тромбированных вен; локальная гипертермия.
УДД 4 УУР С [5,25,40–43]
- При обследовании больного с ТФПВ рекомендуется целенаправленный поиск симптомов ТГВ и ТЭЛА и осмотр обеих нижних конечностей.
УДД 4 УУР C [25,33–35,40]
2.3. Лабораторные диагностические исследования
- Не рекомендуется проведение лабораторных тестов при ТФПВ с целью диагностики или определения тактики лечения.
УДД 5 УУР С [44–46]
Комментарий. Маркёры тромбообразования (D-димер, растворимые фибрин-мономерные комплексы, тромбин-антитромбиновый комплекс, фибринопептиды А и В) не позволяют в полной мере определить активность процесса и оценить вероятность развития ТЭЛА.
- Не рекомендуется обследование на наследственную тромбофилию пациентов с ТФПВ, если результат тестирования не повлияет на тактику тромбопрофилактики пациента или его родственников в ситуациях повышенного риска.
УДД 3 УУР B [44,47,48]
Комментарий. Результаты тестирования на тромбофилию не влияют на тактику лечения пациента. Целесообразность тестирования на наследственную тромбофилию может быть рассмотрена при прогрессировании тромбоза на фоне полноценной антикоагулянтной терапии.
2.4. Инструментальные диагностические исследования
- При подозрении на тромбоз поверхностных вен нижних конечностей рекомендуется выполнение ультразвукового ангиосканирования с оценкой состояния поверхностных и глубоких вен обеих нижних конечностей с целью уточнения диагноза и определения тактики лечения.
УДД 4 УРР C [5,25,40–43,49–51]
Комментарий. Основным методом инструментальной диагностики ТФПВ служит ультразвуковое дуплексное сканирование вен нижних конечностей (ДСВНК). Метод позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба (окклюзивный, пристеночный, флотирующий), его дистальную и проксимальную границы, проходимость глубоких и перфорантных вен. Наиболее высокую диагностическую ценность имеет исследование в В-режиме с компрессией различных венозных сегментов. При ультразвуковом исследовании обязательно точно указать проксимальную границу поражения, отметить наличие/отсутствие варикозной или посттромботической болезни. Ультразвуковое исследование вен нижних конечностей для подтверждения диагноза и уточнения тактики лечения может выполнить любой специалист, занимающийся диагностикой и лечением заболеваний вен и имеющий практический опыт выполнения ультразвукового исследования.
2.5. Иные диагностические исследования
- При подозрении на распространение тромба на глубокие вены и затруднениях в визуализации глубоких вен с помощью дуплексного сканирования вен нижних конечностей рекомендуется выполнение дополнительных методов инструментального обследования (рентгеноконтрастная флебография, магнитно-резонансная томография нижней конечности с внутривенным контрастированием (МР-венография), компьютерная томография нижней конечности с внутривенным болюсным контрастированием (КТ-венография)).
УДД 2 УУР B [52–56]
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.0. Общие положения и тактика лечения ТФПВ
Основными целями лечения ТФПВ являются:
- профилактика распространения тромботического процесса на глубокие вены и развития тромбоэмболии легочной артерии;
- профилактика вовлечения в процесс новых сегментов поверхностных вен.
- купирование острой воспалительной реакции вены и паравазальных тканей;
- купирование симптомов и проявлений ТФПВ;
- предотвращение рецидива ТФПВ.
Для достижения названных целей могут быть использованы разнообразные лекарственные средства, применяемые локально или системно, компрессионная терапия, хирургическое вмешательство, а также комбинации перечисленных методов. Тактика лечения определяется в первую очередь стадией ТФПВ и степенью риска перехода тромба на глубокие вены.
- При принятии решения о необходимости проведения антикоагулянтной терапии, ее интенсивности и продолжительности, помимо степени риска перехода на глубокие вены и стадии ТФПВ, рекомендуется учитывать дополнительные индивидуальные факторы риска ТГВ/ТЭЛА и степень риска геморрагических осложнений.
УДД 5 УУР С [57]
- Степень риска геморрагических осложнений рекомендуется определять в соответствии с градацией ACCP (the American College of Chest Physicians) 10, 2016 г. (Приложение Г1)
УДД 5 УУР С [58]
- С целью купирования воспалительной реакции и симптомов в стадию острого или стихающего ТФПВ рекомендуется использовать краткосрочные курсы системных НПВП, эластичную компрессию, гепаринсодержащие препараты для местного применения и локальную гипотермию.
УДД 5 УУР С [59–65]
- Рекомендуется проводить динамическую оценку течения заболевания не реже одного раза в 5-10 дней с целью исключения прогрессирования тромботического процесса.
УДД 4 УУР С [66]
Комментарий. На фоне проведения адекватной антикоагулянтной терапии риск прогрессирования тромбофлебита и /или развития ТГВ и ТЭЛА невысок. Необходимость в повторном обследовании пациента может возникнуть при появлении клинических признаков прогрессирования заболевания или развития осложнений. Тем не менее, окончательное решение о сроке повторного осмотра после назначения терапии остается за лечащим специалистом, который должен оценить клиническую ситуацию и учесть индивидуальные особенности пациента.
3.0.1. Показания к госпитализации
- Рекомендуется госпитализировать пациента с тромбозом поверхностных вен с высоким риском перехода тромба на глубокие вены в стадию острого ТФПВ или с гнойным тромбофлебитом.
УДД 5 УУР С [44,67]
Комментарий. Во всех остальных случаях решение о госпитализации должно приниматься индивидуально с учетом риска прогрессирования тромбоза и развития тромбоэмболии легочных артерий, стадии заболевания, возможностей проведения адекватной терапии в амбулаторных условиях, приверженности пациента назначениям, а также возможности динамического клинического и ультразвукового контроля за течением заболевания. Оценка перечисленных и других факторов, способных повлиять на исход заболевания, проводится лечащим специалистом индивидуально, в том числе в случаях симультанного тромбоза глубоких вен или при переходе тромба на глубокие вены. При подозрении на развитие ГТ необходимо госпитализировать пациента и дальнейшие диагностические и лечебные мероприятия проводить в условиях стационара.
- Рекомендуется госпитализировать пациента с острой стадией ТФПВ и клиническими признаками острого воспаления, достигающими средней трети бедра в системе БПВ и/или верхней трети голени в системе МПВ при невозможности выполнения ДСВНК.
УДД 5 УУР С [44,68]
3.0.2. Тактика лечения в зависимости от степени риска перехода тромба на глубокие вены и стадии ТФПВ
3.0.2.1. Низкий риск перехода тромба на глубокие вены
- При низком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ с целью профилактики прогрессирования тромбоза рекомендуется использовать системные НПВП.
УДД 1 УУР А [59,60,69–72]
- При низком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ с целью купирования симптомов заболевания рекомендуется использовать нестероидные противовоспалительные препараты (НПВП) системного действия (АТХ: M01A, нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения), гепарин-содержащие препараты для местного применения, эластичную компрессию, локальную гипотермию.
УДД 1 УУР А [63,64,69,71–82]
Комментарий. При низком риске перехода тромба на глубокие вены антикоагулянтная терапия может быть целесообразна для предотвращения прогрессирования тромбоза в поверхностных венах. Решение о целесообразности антикоагулянтной терапии принимается лечащим специалистом с учетом особенностей конкретного клинического случая.
- При низком риске перехода тромба на глубокие вены в стадию стихшего ТФПВ рекомендуется ограничиться симптоматической терапией или наблюдением
УДД 5 УУР C [44,68]
3.0.2.2. Умеренный риск перехода тромба на глубокие вены
- При умеренном риске перехода тромба на глубокие вены в любую стадию ТФПВ рекомендуется считать приоритетным методом лечения антикоагулянтную терапию
УДД 5 УУР C [44,68,83]
Комментарий. При невозможности проведения АКТ в остром периоде заболевания или при стихающем процессе следует рассмотреть целесообразность выполнения приустьевой перевязки (высокого лигирования) или кроссэктомии.
- При умеренном риске перехода тромба на глубокие вены в любую стадию ТФПВ с целью профилактики прогрессирования тромбоза и развития ВТЭО рекомендуется подкожное введение промежуточных доз низкомолекулярных гепаринов (НМГ) (50—75% от лечебной дозы), или подкожное введение фондапаринукса натрия в дозе 2,5 мг 1 раз в сутки.
УДД 1 УУР B [60,69,70,84–87]
- При умеренном риске перехода тромба на глубокие вены в любую стадию ТФПВ и наличии ограничений к применению парентеральных форм антикоагулянтов (АХТ: антитромботические средства) с целью профилактики прогрессирования тромбоза и развития ВТЭО рекомендуется использование #ривароксабана** в дозе 10 мг. в сутки на протяжение 45 дней.
УДД 2 УУР B [88]
3.0.2.3. Высокий риск перехода тромба на глубокие вены
- При высоком риске перехода тромба на глубокие вены в любую стадию ТФПВ с целью профилактики прогрессирования тромбоза и развития ВТЭО рекомендуется использовать лечебные дозы антикоагулянтов (АХТ: антитромботические средства).
УДД 1 УУР B [60,69,84–86]
- При высоком риске перехода тромба на глубокие вены и невозможности АКТ в стадию острого и стихающего ТФПВ с целью профилактики перехода тромба на глубокие вены и развития ВТЭО рекомендуется выполнить приустьевую перевязку (высокое лигирование) или кроссэктомию.
УДД 3 УУР B [44,89–91]
3.0.2.4. Дополнительная терапия в стадию острого и стихающего ТФПВ
- В стадию острого и стихающего ТФПВ, вне зависимости от степени риска перехода тромба на глубокие вены, с целью ускорения реканализации тромбированных поверхностных вен рекомендуется использовать эластичную компрессию с уровнем давления 23-32 мм.рт.ст.
УДД 2 УУР В [75]
- В стадию острого и стихающего ТФПВ, вне зависимости от степени риска перехода тромба на глубокие вены, с целью более быстрого купирования боли рекомендуется использовать НПВП системного действия (АТХ: M01A, нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения), гепарин-содержащие препараты для местного применения, локальную гипотермию.
УДД 5 УУР C [44,67]
- Системные НПВП в дополнение к АКТ с целью более быстрого купирования боли рекомендуется использовать только у пациентов с низким риском геморрагических осложнений (см. Приложение Г1)
УДД 5 УУР C
3.0.2.5. Тактика лечения при флотации тромба в поверхностных венах
- Рекомендуется не учитывать наличие флотации тромба в поверхностных венах при определении тактики лечения
УДД 5 УУР C [44][93]
Комментарий. На сегодняшний день отсутствуют какие-либо указания на возможность развития легочной эмболии при изолированном ТФПВ без вовлечения в патологический процесс глубокой венозной системы. Поэтому обнаружение подобных тромботических масс в поверхностных венах не должно служить поводом к выбору более агрессивной тактики лечения пациента.
3.0.3. Длительность антикоагулянтной терапии
- При умеренном и высоком риске перехода тромба на глубокие вены рекомендуется проведение антикоагулянтной терапии в течение 45 дней от начала ТФПВ.
УДД 2 УУР B [60,70,84,94]
Комментарий. В любой стадии ТФПВ, при невозможности установить дату его начала, допустимо проведение антикоагуляции в течение 45 дней от начала терапии.
Оптимальная длительность применения антикоагулянтных препаратов (АХТ: антитромботические средства) при лечении ТФПВ до сих пор не установлена. Основанием для формирования рекомендаций по длительности АКТ в первую очередь являются данные масштабного РКИ CALISTO, включившего 3002 участника [84]. Исследование STEFLUX продемонстрировало, что длительное применение (30 суток) промежуточных доз парнапарина натрия** имеет преимущество перед краткосрочным курсом введения препарата (10 суток) [85].
- Рекомендуется оценить целесообразность сокращения длительности АКТ при полном регрессе симптомов воспаления, отсутствии дополнительных факторов риска прогрессирования или рецидива тромбофлебита и развития ТГВ в сочетании с повышенным риском развития геморрагических осложнений.
УДД 5 УУР C [44,57]
- Рекомендуется оценить целесообразность продления АКТ ТФПВ сверх 45 дней при рецидивирующем характере тромбоза, сохранении у пациента симптомов по завершении лечения или при наличии дополнительных факторов риска ВТЭО.
УДД 2 УУР А [27,84,85,88]
Комментарий. В большинстве исследований, включавших оценку эффективности антикоагулянтной терапии ТФПВ у пациентов с дополнительными факторами риска ВТЭО, в том числе в рандомизированном исследовании SURPRISE, частота развития тромботических событий возрастала значительным образом после завершения курса лечения [60,85,88]. В связи с этим, при обнаружении у пациента названных факторов риска срок антикоагулянтной терапии может быть продлен (более 45 дней).
3.0.4. Прогрессирование ТФПВ
- При отсутствии положительной динамики клинических проявлений ТВПФ на фоне проводимого лечения для выявления прогрессирования тромбоза (распространения тромба на ранее не тромбированные участки поверхностных вен) рекомендуется повторное выполнение дуплексного сканирования вен нижних конечностей.
УДД 4 УУР С [44,95][24]
Комментарий. Необходимость и кратность повторных ультразвуковых исследований определяет проводящий наблюдение и лечение врач.
- При инструментальном подтверждении или клинических признаках прогрессирования ТФПВ, если в лечении ТФПВ не использовались антитромботические средства, в любой стадии ТФПВ с целью профилактики дальнейшего прогрессирования тромбоза, перехода тромба на глубокие вены и развития ВТЭО рекомендуется провести антикоагулянтную терапию в соответствии с риском перехода тромба на глубокие вены
УДД 3 УУР C [44][69][96]
- При инструментальном подтверждении или клинических признаках прогрессирования ТФПВ, если в лечении ТФПВ использовались антитромботические средства, в любой стадии ТФПВ с целью профилактики дальнейшего прогрессирования тромбоза, перехода тромба на глубокие вены и развития ВТЭО рекомендуется оценить выполнение пациентом назначений и увеличить дозу антикоагулянта (АХТ: антитромботические средства).
УДД 2 УУР B [44][97]
- При инструментальном подтверждении или клинических признаках прогрессирования ТФПВ в любой стадии ТФПВ рекомендуется рассмотреть целесообразность госпитализации
УДД 5 УУР C [68]
3.1. Особые ситуации, влияющие на тактику обследования и лечения
3.1.1. Симультанный ТГВ или переход тромба на глубокие вены
- При симультанном ТГВ или переходе тромба на глубокие вены рекомендовано лечение в соответствии с рекомендациями по лечению ТГВ и назначением лечебной дозы антикоагулянта (АХТ: антитромботические средства) не менее, чем на 3 мес.
УДД 5 УУР C [98]
3.1.2. Тромбофлебит неварикозных поверхностных вен
- Лечение ТНПВ рекомендуется проводить в соответствии с рекомендациями лечения ТФПВ
УДД 5 УУР C [44][68]
Комментарий. Тромбофлебит неварикозных поверхностных вен в сравнении с варикотромбофлебитом ассоциирован с 1,8-кратным увеличением риска обнаружения тромбоза глубоких вен и легочной эмболии на момент первичной диагностики и 2-2,5-кратным увеличением риска развития ВТЭО на протяжении следующих 3-х месяцев наблюдения [36,99,100].
- В случае ТНПВ, при наличии симптомов, лабораторных или инструментальных признаков, указывающих на возможность наличия онкозаболевания, для оценки необходимости и проведения онкопоиска рекомендуется направить пациента к врачу общей практики, врачу-терапевту или к врачу - онкологу.
УДД 4 УУР C [10,101]
Комментарий. У 10-20% пациентов с ТНПВ вен обнаруживают онкологическую патологию [8,10].
- Для лечения постинъекционного ТФПВ в стадию острого и стихающего тромбофлебита с целью более быстрого купирования симптомов рекомендуется использовать системные и/или местные формы НПВП и/или местные гепарин натрия** - содержащие средства
УДД 1 УУР C [44][102]
3.1.3. Рецидивирующий тромбофлебит
- Лечение рецидива ТФПВ рекомендуется проводить в соответствии с рекомендациями по лечению первого эпизода ТФПВ.
УДД 5 УУР C [44][68]
3.1.4. Гнойный тромбофлебит
- При подозрении на гнойный тромбофлебит рекомендуется госпитализация в стационар и ранняя эмпирическая антибактериальная терапия.
УДД 5 УУР C [103–105]
Комментарий. При исходном тромбозе поверхностных вен следует заподозрить возможное формирование ГТ при чрезмерно выраженных местных признаках воспаления и наличии двух и более признаков системной воспалительной реакции (температура тела >38℃ или <36℃, ЧСС >90/мин, частота дыхания >20/мин, лейкоцитоз >12*109/л (или лейкопения <4*109/л, или смещение лейкоцитарной формулы влево с наличием >10% палочкоядерных форм). Безусловным признаком ГТ является выделение гноя из места пункции вены. Базовая терапия ГТ не отличается от терапии ТФПВ. Консервативное лечение следует начинать с эмпирической терапии, затем проводить ее корректировку в зависимости от вида возбудителя и его чувствительности [103–105]. Лечение должно включать дренирование первичного очага инфекции [103,106,107].
3.1.5. Тромбофлебит поверхностных вен верхних конечностей
Тактика ведения ТФПВ верхних конечностей у пациентов со злокачественным новообразованием отличается и представлен отдельно (см. раздел 3.2.7).
- Если развитие тромбофлебита поверхностных вен верхних конечностей ассоциировано с периферическим внутривенным катетером, рекомендуется прекращение внутривенного введения препаратов через этот катетер и его удаление
УДД 4 УУР C [44,108]
- При тромбофлебите поверхностных вен верхних конечностей в стадию острого и стихающего ТФПВ с целью более быстрого купирования симптомов рекомендуется использовать НПВП системного действия (АТХ: M01A, нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения), гепарин-содержащие препараты для местного применения, локальную гипотермию
УДД 4 УУР C [44,59,61,62] [109][110]
3.1.6. Тромбофлебит поверхностных вен во время беременности и в послеродовом периоде
В настоящее время нет ни рандомизированных, ни обсервационных исследований особенностей лечения ТФПВ именно у беременных пациенток. Небольшое количество публикаций представлено описаниями клинических случаев. Среди рекомендаций, затрагивающих проблему лечения и профилактики ВТЭО у беременных, ТФПВ как самостоятельный вариант перинатальных ВТЭО рассмотрен только в рекомендациях Американского общества гематологии (American Society of Hematology, ASH) [111]. Указанные рекомендации являются согласованным мнением группы экспертов ASH без прямой доказательной базы. Настоящие рекомендации по ведению беременных женщин с ТФПВ базируются на существующих отечественных и зарубежных рекомендациях по профилактике и лечению ВТЭО, а также экстраполируют данные исследований с участием небеременных пациентов [89,111–116].
3.1.6.1. Общие положения
- Риск развития и рецидива ВТЭО во время беременности и в послеродовом периоде рекомендуется оценивать с учетом градации значимости факторов риска (Приложение Г2)
УДД 5 УУР С [89,113,114]
- При определении тактики лечения после перенесенного ТФПВ рекомендуется учитывать перенесенный ТФПВ как 1 фактор среднего риска.
УДД 4 УУР C [89,111–116][109]
- Факторы риска геморрагических осложнений рекомендуется учитывать в соответствии с рекомендациями RCOG/РОАГ (Приложение А3.1)
УДД 5 УУР С [89,113,114]
- Дозы НМГ для профилактики и лечения ТФПВ во время беременности и в послеродовом периоде рекомендуется определять в соответствии с Приложениями А3.2 и А3.3 с учетом веса до беременности.
УДД 5 УУР С [89,113,114]
- После родоразрешения рекомендуется провести переоценку факторов риска ВТЭО для определения дозировки антикоагулянта (АХТ: антитромботические средства) и длительности антикоагуляции в послеродовом периоде
УДД 4 УУР C [109,115,117]
3.1.6.2. Показания к госпитализации
Во время беременности и в послеродовом периоде действительны общие для пациентов с ТФПВ показания к госпитализации:
- высокий риск перехода тромба на глубокие вены в острый период ТФПВ;
- гнойный тромбофлебит;
- невозможность ДСВНК у пациентов с острой стадией ТФПВ с клиническими признаками острого воспаления, достигающими средней трети бедра в системе БПВ и/или верхней трети голени в системе МПВ.
Вместе с тем, любые дополнительные факторы риска рецидива ВТЭО или развития геморрагических осложнений целесообразно рассматривать как аргумент в пользу госпитализации.
3.1.6.3. Тактика при остром и стихающем тромбофлебите во время беременности
В разделе представлена тактика лечения ТФПВ в зависимости от степени риска перехода тромба на глубокие вены, стадии ТФПВ, срока беременности и наличия дополнительных факторов риска рецидива ВТЭО. В табличном виде тактика лечения ТФПВ во время беременности представлена в Приложении А3.4.
Целью антикоагуляции в стадию острого и стихающего ТФПВ во время беременности и в послеродовом периоде является профилактика прогрессирования ТФПВ и развития симультанного ТГВ и/или ТЭЛА. Целью антикоагуляции в стадию стихшего ТФПВ во время беременности и в послеродовом периоде является профилактика рецидива венозного тромбоза и развития ВТЭО.
Представления о целесообразности пролонгированной антикоагулянтной терапии на протяжении беременности и в послеродовом периоде базируются на данных о увеличении риска ВТЭО у беременных и родильниц по сравнению с небеременными женщинами фертильного возраста, увеличение риска симультанного ТГВ у пациенток с репродуктивными факторами риска на фоне ТФПВ, сохранении риска рецидива ВТЭО до 6 мес после острого периода ТФПВ (у небеременных пациентов), а также данных о снижении риска рецидива ВТЭО и смертности у беременных пациенток с острыми ВТЭО на фоне антикоагулянтной терапии при сохранении низкого риска таких осложнений, как геморрагические, остеопения, гепарин-индуцированная тромбоцитопения [118–133].
Низкий риск в стадию острого и стихающего тромбофлебита
- При низком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ рекомендуется проведение антикоагулянтной терапии с помощью промежуточных доз НМГ (50-75% от лечебной дозы) до 45 дней от начала ТФПВ (до перехода в стихший период).
УДД 2 УУР B [127–129]
- После завершения 45-дневного курса антикоагулянтной терапии для решения вопроса ее отмены или пролонгирования рекомендуется оценить риск развития повторного эпизода ВТЭО.
УДД 5 УУР C [115,116]
- При выявлении хотя бы 1-го дополнительного фактора высокого риска, или 3-х и более дополнительных факторов среднего и/или низкого риска, вне зависимости от срока беременности на момент развития ТФПВ, рекомендуется продлить антикоагуляцию профилактическими дозами НМГ на весь оставшийся срок беременности и на 6 недель послеродового периода.
УДД 5 УУР С [113,114,127–129]
- При выявлении 2-х дополнительных факторов среднего и/или низкого риска и развитии ТФПВ с 20 недели беременности рекомендуется продлить антикоагуляцию профилактическими дозами НМГ на весь оставшийся срок беременности и не менее 10 дней послеродового периода.
УДД 5 УУР С [113,114,127–129]
- При выявлении 2-х дополнительных факторов среднего и/или низкого риска и развитии ТФПВ до 20 недели беременности рекомендуется временно завершить антикоагулянтную терапию после 45-дневного курса и возобновить ее с помощью профилактических доз НМГ с 28 недели беременности до родоразрешения и не менее 10 дней послеродового периода.
УДД 5 УУР С [113,114,127–129]
Комментарий. Гестационный срок в 20 недель в качестве ориентира для выбора тактики антенатальной антикоагуляции выбран с учетом рекомендаций RCOG/РОАГ по началу антикоагулянтной профилактики ВТЭО с 28 недель беременности при наличии совокупности 3-х факторов среднего или низкого риска ВТЭО. В том случае, если срок беременности на момент подтверждения ТФПВ будет составлять менее 20 недель, промежуток времени от момента завершения стандартного 45-дневного курса лечения и до наступления 28 недель беременности представляется достаточным и целесообразным для временной отмены антикоагулянтов.
- При выявлении 1-го дополнительного фактора среднего или низкого риска, а также при отсутствии дополнительных факторов риска, продолжение антикоагулянтной терапии после 45-дневного курса не рекомендуется.
УДД 5 УУР С [113,114,127–129]
- При выявлении 1-го дополнительного фактора среднего или низкого риска, а также при отсутствии дополнительных факторов риска, после родоразрешения рекомендуется проведение антикоагулянтной профилактики рецидива ВТЭО с помощью профилактических доз НМГ не менее 10 дней.
УДД 5 УУР С [113,114,127–129]
Умеренный риск в стадию острого и стихающего тромбофлебита
- При умеренном риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ рекомендуется проведение антикоагулянтной терапии с помощью промежуточных доз НМГ (50-75% от лечебной дозы) до 45 дней от начала ТФПВ (до перехода в стихший период).
УДД 5 УУР С [127–129,134]
- После завершения стандартного 45-дневного курса рекомендуется продлить антикоагуляцию на весь оставшийся срок беременности и на 6 недель послеродового периода профилактической дозой НМГ.
УДД 5 УУР С [113,114,127–129]
Высокий риск в стадию острого и стихающего тромбофлебита
- При высоком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ рекомендуется проведение антикоагулянтной терапии с помощью лечебных доз НМГ до 45 дней от начала ТФПВ (до перехода в стихший период).
УДД 5 УУР С [113,114,127–129]
- После завершения стандартного 45-дневного курса рекомендуется продлить антикоагуляцию на весь оставшийся срок беременности и на 6 недель послеродового периода профилактической дозой НМГ.
УДД 5 УУР С [113,114,127–129]
3.1.6.4. Тактика при выявлении стихшего ТФПВ, развившегося во время беременности
- При выявлении стихшего ТФПВ развившегося во время беременности, для определения тактики рекомендуется оценить риск развития повторного эпизода ВТЭО.
УДД 5 УУР С [113,114,127–129]
- При наличии хотя бы 1-го дополнительного фактора высокого риска или 3-х и более факторов среднего и/или низкого риска рекомендуется начать и провести антикоагуляцию весь оставшийся срок беременности и в течение 6 недель послеродового периода профилактической дозой НМГ.
УДД 5 УУР С [113,114,127–129]
- При наличии 2-х дополнительных факторов среднего и/или низкого риска рекомендуется начать и провести антикоагуляцию с 28 недели беременности до родоразрешения и не менее 10 дней послеродового периода профилактической дозой НМГ.
УДД 5 УУР С [113,114,127–129]
- При наличии только 1-го дополнительного фактора среднего или низкого риска, а также при отсутствии дополнительных факторов риска, проведение антикоагулянтной терапии в оставшийся срок беременности не рекомендуется.
УДД 5 УУР С [113,114,127–129]
- При наличии только 1-го дополнительного фактора среднего или низкого риска, а также при отсутствии дополнительных факторов риска, рекомендуется проведение антикоагулянтной профилактики рецидива ВТЭО после родоразрешения профилактической дозой НМГ не менее 10 дней.
УДД 5 УУР С [113,114,127–129]
3.1.6.5. Тактика при остром и стихающем тромбофлебите в послеродовом периоде
В разделе представлена тактика лечения ТФПВ в послеродовом периоде в зависимости от степени риска перехода тромба на глубокие вены, стадии ТФПВ и наличия дополнительных факторов риска рецидива ВТЭО. Послеродовым периодом в данном случае назван период в 6 недель после родов, в который повышен риск развития ВТЭО. В табличном виде тактика лечения ТФПВ в послеродовом периоде представлена в Приложении А3.5. Целью антикоагуляции в стадию острого и стихающего ТФПВ в послеродовом периоде является профилактика прогрессирования ТФПВ и развития симультанного ТГВ и/или ТЭЛА. Целью антикоагуляции в стадию стихшего ТФПВ в послеродовом периоде является профилактика рецидива венозного тромбоза и развития ВТЭО.
- При низком или умеренном риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ в послеродовом периоде рекомендуется проведение антикоагулянтной терапии с помощью промежуточных доз НМГ (50-75% от лечебной дозы) в течение 45 дней от начала ТФПВ вне зависимости от наличия дополнительных факторов риска.
УДД 5 УУР С [113,114,127–129]
- При высоком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ в послеродовом периоде рекомендуется проведение антикоагулянтной терапии с помощью лечебных доз НМГ в течение 45 дней от начала ТФПВ.
УДД 4 УУР С [113,114,117,127–129]
3.1.6.6. Тактика при выявлении в послеродовом периоде стихшего тромбофлебита, развившегося во время беременности
- При выявлении в послеродовом периоде стихшего ТФПВ, развившегося во время беременности, для определения тактики рекомендуется оценить риск развития повторного эпизода ВТЭО.
УДД 5 УУР С [113,114,127–129]
- При наличии хотя бы 1-го дополнительного фактора высокого риска или 3-х и более факторов среднего и/или низкого риска рекомендуется начать и провести антикоагуляцию до срока 6 недель от родов профилактической дозой НМГ.
УДД 5 УУР С [127–129,134]
- При наличии 2-х или менее дополнительных факторов среднего и/или низкого риска, или при отсутствии дополнительных факторов риска, рекомендуется начать и провести антикоагуляцию до срока 10 дней от родов профилактической дозой НМГ или ограничиться наблюдением.
УДД 5 УУР С [127–129,134]
3.1.6.7. Особенности антикоагулянтной терапии на фоне беременности и послеродового периода
- Для проведения антикоагулянтной терапии/профилактики в антенатальном и постнатальном периоде, в том числе на фоне лактации и грудного вскармливания, рекомендуется использовать НМГ (АТХ: B01AB Группа гепарина)
УДД 5 УУР С [89,111–116,135–137]
Комментарий. Применимость НМГ в лечении ТФПВ обсуждена отдельно (см. пункт 3.3.3.2. Низкомолекулярные гепарины) (АТХ: B01AB Группа гепарина).
- При экстремально низкой или высокой массе тела рекомендуется проводить оценку адекватности суточной дозы НМГ с помощью определения анти-Ха-активности.
УДД 5 УУР C [127–129,137]
Комментарий. Суточная доза НМГ, за исключением парнапарина натрия**, зависит от массы тела до беременности. Суточная доза парнапарина натрия** – как лечебная, так и промежуточная и профилактическая – фиксирована и не зависит от массы тела до беременности.
- Фондапаринукс натрия, используемый при лечении ТФПВ у небеременных пациенток, не рекомендуется к рутинному применению у беременных и кормящих женщин.
УДД 5 УУР C [127–129,137]
Комментарий. Фондапаринукс натрия проникает через гематоплацентарный барьер, и в настоящее время недостаточно данных о его безопасности для эмбриона/плода.
- Ривароксабан**, используемый при лечении ТФПВ у небеременных пациенток, не рекомендуется к применению у беременных и кормящих женщин.
УДД 5 УУР C [127–129,137]
Комментарий. Ривароксабан** проникает через гематоплацентарный барьер, в настоящее время нельзя исключить его эмбрио- и фетотоксичность [138,139]. Данные о том, проникает ли ривароксабан** в грудное молоко у женщин или нет, в настоящее время отсутствуют.
3.1.6.8. Родоразрешение у женщин, получающих НМГ в связи с ТФПВ
Рекомендации по управлению антикоагуляцией при ожидаемом родоразрешении основаны на стандартных клинических рекомендациях по лечению и профилактике перинатальных ВТЭО RCOG, РОАГ, ASH [111,113–115]. В настоящее время нет оснований считать, что ТФПВ требует отдельных тактических решений в данный период.
- Тактику родоразрешения рекомендуется определять в первую очередь по акушерской ситуации.
УДД 5 УУР C [111,113–115]
- При начале родовой деятельности рекомендуется прекратить применение НМГ.
УДД 5 УУР C [111,113–115]
- В случае невозможности прекращения введения НМГ в родах (например, у женщин с самопроизвольными родами в течение 12 часов после введения последней терапевтической дозы НМГ) не рекомендуется выполнение методик регионарной анестезии/анальгезии.
УДД 5 УУР C [111,113–115]
- При планируемом начале родоразрешения (плановое кесарево сечение, программируемые роды) последнее введение профилактической дозы НМГ рекомендуется за 12 часов до начала родовой деятельности, промежуточной и лечебной дозы НМГ – за 24 часа до начала родовой деятельности.
УДД 5 УУР C [111,113–115]
- Применение методик регионарной анестезии/анальгезии рекомендуется не ранее 12 часов после введение последней профилактической дозы НМГ и не ранее 24 часов после введения промежуточной или лечебной дозы НМГ.
УДД 5 УУР C [111,113–115]
- Возобновление профилактических НМГ рекомендуется через 6-12 часов после родоразрешения, но не раньше, чем через 4-6 часов после применения спинномозговой анестезии или удаления эпидурального катетера.
УДД 5 УУР C [111,113–115]
Комментарий. Возобновление применения НМГ в указанные сроки возможно при отсутствии геморрагических осложнений раннего послеродового периода и отсутствии травматичной эпидуральной пункции.
- Возобновление промежуточных и лечебных доз НМГ рекомендуется через 24 часа после родоразрешения и не раньше, чем через 24 часа после применения спинномозговой анестезии или удаления эпидурального катетера.
УДД 5 УУР C [111,113–115]
Комментарий. Возобновление применения НМГ в указанные сроки возможно при отсутствии геморрагических осложнений раннего послеродового периода и отсутствии травматичной эпидуральной пункции.
3.1.6.9. Другая медикаментозная терапия ТФПВ на фоне беременности и в послеродовом периоде, в т.ч. в период грудного вскармливания
- Применение НПВП (АТХ: M01A Нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения) и парацетамола (АТХ: N02BE01) на фоне беременности и при грудном вскармливании не рекомендуется.
УДД 3 УУР B [140–150].
Комментарий расширенной версии (не входит в текст, утвержденный Минздравом РФ).
Такие НПВС как ибупрофен**, диклофенак**, напроксен, целекоксиб кетопрофен**, индометацин при пероральном и парентеральном введении проникают через гематоплацентарный барьер. Применение НПВП в 3 триместре увеличивает риск преждевременного закрытия Боталлова протока и развитием персистирующей легочной гипертензии у ребенка, ассоциируется с олиогидроамнионом, нефротоксичностью для плода и риском перивентрикулярных кровоизлияний [1–5]. В настоящее время в США, согласно правилу маркировки лекарств для беременности и лактации, принятому FDA в 2015 г, рекомендовано [6–9]:
- избегать использования НПВП в течение последнего триместра беременности;
- до 30 недель беременности НПВП (ибупрофен**, диклофенак**, напроксен, целекоксиб кетопрофен**, индометацин) применять только в том случае, если потенциальная польза оправдывает потенциальный риск для плода.
Парацетамол** обладает слабым противовоспалительным действием, но потенциально может рассматриваться как анальгетик при выраженном болевом синдроме за счет воспалительных изменений мягких тканей. Парацетамол** также, как и другие НПВП, проникает через гематоплацентарный барьер. Рекомендации FDA допускают его использование «с осторожностью» и предлагают избегать рутинного применения [10,11].
НПВП проникают в грудное молоко в низкой концентрации. НПВП с коротким периодом полувыведения (#ибупрофен**, #диклофенак**) большинством исследователей рассматриваются приемлемыми для использования у кормящих женщин. Предпочтительным является #ибупрофен**, так как помимо короткого периода полувыведения, он имеет доказательства безопасности применения у детей, при этом концентрации его, фиксируемые в грудном молоке значительно ниже используемых у детей, в том числе новорожденных [12–16]. #Парацетамол** рассматривается как допустимый для применения у кормящих женщин [10,17–20]. В систематическом обзоре исследований, затрагивающих вопросы побочных эффектов краткосрочного применения НПВП, краткосрочным названо применение курсом до 10 дней [21].
Литература
- Nakhai-Pour H.R., et al. Use of nonaspirin nonsteroidal anti-inflammatory drugs during pregnancy and the risk of spontaneous abortion. // CMAJ. 2011. Vol. 183, № 15. P. 1713–1720.
- Nielsen G.L., et al. Risk of adverse birth outcome and miscarriage in pregnant users of non-steroidal anti-inflammatory drugs: population based observational study and case-control study. // BMJ. 2001. Vol. 322, № 7281. P. 266–270.
- Nielsen G.L., et al. Danish group reanalyses miscarriage in NSAID users. // BMJ. 2004. Vol. 328, № 7431. P. 109.
- Li D.-K., Liu L., Odouli R. Exposure to non-steroidal anti-inflammatory drugs during pregnancy and risk of miscarriage: population based cohort study. // BMJ. 2003. Vol. 327, № 7411. P. 368.
- Edwards D.R.V., et al. Periconceptional over-the-counter nonsteroidal anti-inflammatory drug exposure and risk for spontaneous abortion. // Obs. Gynecol. 2012. Vol. 120, № 1. P. 113–122.
- MHRA Medicines and Health Regulatory Agency. MHRA Drug Safety Update [Electronic resource] // 2015. 2020. URL: http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUpdate (accessed: 09.10.2020).
- Rigourd V., et al. Ibuprofen concentrations in human mature milk--first data about pharmacokinetics study in breast milk with AOR-10127 “Antalait” study. // Ther Drug Monit. United States, 2014. Vol. 36, № 5. P. 590–596.
- Stanley A.Y., et al. Safety of Over-the-Counter Medications in Pregnancy. // MCN Am J Matern Child Nurs. United States, 2019. Vol. 44, № 4. P. 196–205.
- New FDA Pregnancy Categories Explained [Electronic resource] // 2015. URL: https://www.drugs.com/pregnancy-categories.html (accessed: 09.10.2020).
- Briggs G., Freeman R. Acetaminophen // Drugs Pregnancy Lact. A Ref. Guid. to Fetal Neonatal Risk. 11th ed. Philadelphia: Wolters Kluwer Health, 2017. P. 66–74.
- Stergiakouli E., Thapar A., Davey Smith G. Association of Acetaminophen Use During Pregnancy With Behavioral Problems in Childhood: Evidence Against Confounding. // JAMA Pediatr. 2016. Vol. 170, № 10. P. 964–970.
- Ito S., et al. Prospective follow-up of adverse reactions in breast-fed infants exposed to maternal medication. // Am J Obs. Gynecol. United States, 1993. Vol. 168, № 5. P. 1393–1399.
- Temprano K.K., Bandlamudi R., Moore T.L. Antirheumatic drugs in pregnancy and lactation. // Semin Arthritis Rheum. United States, 2005. Vol. 35, № 2. P. 112–121.
- Østensen M.. Safety of Non-Steroidal Anti-Inflammatory Drugs during Pregnancy and Lactation // Side Eff. Anti-inflamm. Drugs. IV / ed. Rainsford K.D. Springer, 1997.
- Spigset O., Hägg S. Analgesics and breast-feeding: safety considerations. // Paediatr Drugs. Switzerland, 2000. Vol. 2, № 3. P. 223–238.
- Janssen N.M., Genta M.S. The effects of immunosuppressive and anti-inflammatory medications on fertility, pregnancy, and lactation. // Arch Intern Med. United States, 2000. Vol. 160, № 5. P. 610–619.
- Berlin C.M.J., Yaffe S.J., Ragni M. Disposition of acetaminophen in milk, saliva, and plasma of lactating women. // Pediatr Pharmacol (New York). United States, 1980. Vol. 1, № 2. P. 135–141.
- Bitzén P.O., et al. Excretion of paracetamol in human breast milk. // Eur J Clin Pharmacol. Germany, 1981. Vol. 20, № 2. P. 123–125.
- Findlay J.W., et al. Analgesic drugs in breast milk and plasma. // Clin Pharmacol Ther. United States, 1981. Vol. 29, № 5. P. 625–633.
- Sachs H.C. The transfer of drugs and therapeutics into human breast milk: an update on selected topics. // Pediatrics. United States, 2013. Vol. 132, № 3. P. e796-809.
- Aminoshariae A., Kulild J.C., Donaldson M. Short-term use of nonsteroidal anti-inflammatory drugs and adverse effects: An updated systematic review. // J Am Dent Assoc. England, 2016. Vol. 147, № 2. P. 98–110.
- Применение ацетилсалициловой кислоты** (АСК**) в качестве антитромботического средства для лечения ТФПВ во время беременности и послеродового периода не рекомендуется.
УДД 5 УУР C [115,116,151–155]
Комментарий. АСК** не рекомендована к применению у небеременных пациентов с ТФПВ в связи с меньшей эффективностью по сравнению со стандартной антикоагулянтной терапией, соответственно, в настоящее время нет предпосылок для расширения показаний к применению АСК** в лечении ТФПВ у беременных и кормящих. В настоящее время применение низких (50-150 мг/сут) доз АСК** во время беременности допускается в первую очередь в рамках профилактики преэклампсии [115,116,151,152].
АСК** проникает в грудное молоко и уровень салицилатов в грудном молоке зависит от уровня принимаемой матерью суточной дозы. В настоящее время низкие дозы АСК** (не более 162мг/сут) экспертами рассматриваются как сочетаемые с грудным вскармливанием, однако ребенок должен быть под тщательным наблюдением (риск гемолиза, тромбоцитопении с геморрагическим синдромом, метаболического ацидоза) [153–155].
- С целью купирования местных симптомов воспаления в период острого или стихающего ТФПВ во время беременности и в период грудного вскармливания рекомендуется использовать гепаринсодержащие препараты для местного применения (АТХ группа: C05BA гепарин-содержащие препараты для местного применения) (мази, гели) на основе гепарина натрия в составе комплексной терапии.
УДД 4 УУР C [112,156–158]
Комментарий расширенной версии (не входит в текст, утвержденный Минздравом РФ). В настоящее время отсутствуют данные о безопасности применения топических форм НПВП во время 1 и 2 триместров беременности и на фоне грудного вскармливания. В систематическом обзоре исследований, затрагивающих вопросы побочных эффектов краткосрочного применения НПВП, краткосрочным названо применение курсом до 10 дней [1]
Литература.
- Aminoshariae A., Kulild J.C., Donaldson M. Short-term use of nonsteroidal anti-inflammatory drugs and adverse effects: An updated systematic review. // J Am Dent Assoc. England, 2016. Vol. 147, № 2. P. 98–110.
3.1.7. Тромбофлебит поверхностных вен у онкологических пациентов
3.1.7.1. Общие положения
За основу данного раздела взяты рекомендации NCCN 2020 в части тромбозов поверхностных вен [159]. В подавляющем большинстве случаев наличие ТФВП не является противопоказанием к противоопухолевому лечению. С другой стороны, изолированный тромбоз поверхностных вен влияет на прогноз жизни пациента со злокачественным новообразованием аналогично влиянию на такой прогноз ТГВ и ТЭЛА. В частности, в обсервационном исследовании смертность онкологических пациентов с ТФПВ оценена в 23% пациентов-в-год, что соответствует таковой для онкологических пациентов с ТГВ (сОР 1,0 (95%ДИ 0,6-1,9)) [160]. Возможно, это требует более активной и длительной антикоагулянтной терапии ТФПВ у пациентов со злокачественными новообразованиями в сравнении с терапией ТФПВ вне рака. Частота ТЭЛА при тромбозе поверхностных вен у онкологических пациентов в одном из когортных исследований оценена в 4% [161].
- У пациента с установленным онкологическим диагнозом при клиническом подозрении на тромбоз поверхностных вен или установленном диагнозе ТФПВ рекомендуется определить уровень тромбоцитов с целью оценки возможности применения антикоагулянтов.
УДД 5 УУР C [159]
- При проведении симптоматической терапии у пациентов с онкологическим диагнозом и ТФПВ рекомендуется клинический и/или ультразвуковой контроль прогрессирования тромбоза и рассмотрение целесообразности проведения антикоагулянтной терапии (АХТ: антитромботические средства) при признаках прогрессирования.
УДД 2 УУР B [95,159]
Комментарий. Сроки проведения контрольных осмотров или исследований определяет специалист, проводящий лечение.
- При проведении антикоагулянтной терапии у пациентов с онкологическим диагнозом и ТФПВ рекомендуется использовать #ривароксабан** 10 мг. в стуки, или #фондапаринукса натрий 2,5 мг. в сутки подкожно.
УДД 2 УУР А [88,159]
Комментарий 1. #Ривароксабан** и #фондапаринукса натрий в указанных режимах применения показали эффективность в исследовании по лечению ТФПВ, включавшем некоторое количество онкологических пациентов, и рекомендованы NCCN [88,159]. Окончательный выбор антикоагулянта определяется специалистом, проводящим лечение, с учетом особенностей клинической ситуации, оценки баланса риска и пользы применения конкретных препаратов, стоимости и доступности препаратов, предпочтений пациента. Необходимо принимать во внимание, что при лечении ТГВ и ТЭЛА у пациентов с гастроэзофагеальными опухолями предпочтительными препаратами для антикоагуляции являются НМГ, тогда как ПОАК не рекомендуются для применения [159]. Для антикоагулянтной терапии ТФПВ допустимо применение НМГ (АТХ группа: B01AB Группа гепарина) либо гепарина натрия** в дозах, рекомендованных для лечения ТФПВ у пациентов без злокачественного новообразования.
Комментарий 2. При проведении антикоагулянтной терапии у пациентов с онкологическим диагнозом и ТФПВ по решению специалиста, проводящего лечение, дозы рекомендованных антикоагулянтов могут быть увеличены до лечебных.
3.1.7.2. Тактика лечения онкологического пациента с ТФПВ
- У пациентов с установленным онкологическим диагнозом и наличием ТФПВ верхних или нижних конечностей, ассоциированного с периферическим катетером, рекомендовано удаление периферического катетера
УДД 5 УУР C [159,162,163]
- У пациентов с установленным онкологическим диагнозом и наличием ТФПВ нижних конечностей в стадию острого и стихающего ТФПВ с целью профилактики прогрессирования тромбоза рекомендуется антикоагуляция не менее 45 дней с последующей оценкой баланса риска и пользы продления антикоагуляции
УДД 5 УУР C [44,159]
Комментарий. При ТФПВ нижних конечностей у пациента со злокачественным новообразованием риск перехода тромба на глубокие вены не является параметром, определяющим тактику лечения. Кроме того, тактика в описанной ситуации не зависит от наличия или отсутствия ассоциации ТФПВ с периферическим катетером. В рекомендациях NCCN допускается симптоматическая терапия без антикоагуляции у пациентов с ТФПВ, локализованном на голени, ассоциированным с катетером и только после удаления катетера [159].
- У пациентов с установленным онкологическим диагнозом и наличием ТФПВ верхних конечностей в стадию острого и стихающего ТФПВ без распространения на поверхностные или глубокие вены плеча с целью профилактики прогрессирования тромбоза и купирования симптомов заболевания рекомендуется использовать НПВП системного действия (АТХ: M01A, нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения), гепарин-содержащие препараты для местного применения, локальную гипотермию.
УДД 5 УУР C [40,44,89,102,163–165]
- У пациентов с установленным онкологическим диагнозом и наличием ТФПВ верхних конечностей в стадию острого и стихающего ТФПВ с распространением на поверхностные или глубокие вены плеча рекомендуется рассмотреть вопрос о назначении антикоагулянтной терапии с целью профилактики прогрессирования тромбоза
УДД 5 УУР C [44,89,102,163,164]
- У пациентов с установленным онкологическим диагнозом и наличием ТФПВ верхних конечностей в любую стадию ТФПВ с распространением на поверхностные или глубокие вены плеча ближе 3 см. от подмышечной (аксиллярной) вены с целью профилактики рецидива, прогрессирования тромбоза и развития ВТЭО рекомендуется проведение антикоагулянтной терапии.
УДД 5 УУР C [44,89,163,164]
3.1.7.3. ТПФВ при наличии устройств постоянного венозного доступа
- Рекомендуется выполнение ультразвукового исследования онкологическим пациентам с установленной системой PICC через 1 неделю после установки PICC с целью выявления бессимптомного венозного тромбоза.
УДД 4 УУР С [166]
Комментарий. В проспективном исследовании общая частота развития ассоциированного с PICC бессимптомного тромбоза вен верхних конечностей составила 48,8%, медиана времени развития составила 3 дня. При этом частота развития тромбоза за сутки определена как 37%, а за неделю – как 85,5% [166]. Кроме того, ТФПВ у данной категории пациентов характеризуются высоким риском перехода из поверхностных в глубокие вены. Учитывая сказанное, целесообразно при постановке PICC исходно рассмотреть вопрос проведения фармакологической тромбопрофилактики. При ТФПВ, ассоциированном с наличием периферически имплантируемого центрального венозного катетера (PICC), и его нормальном функционировании, удаление катетера не обязательно [159].
3.1.7.4. Оценка риска прогрессирования или рецидива ТПФВ
- К дополнительным факторам риска прогрессирования или рецидива ТФПВ у пациентов со злокачественным новообразованием рекомендуется относить:
- сохранение/усиление симптомов несмотря на проводимую терапию;
- множественное тромботическое поражение (особенно, если не связано с наличием катетеров); прогрессирование тромба несмотря на удаление катетера и начало лечения
- продвинутые стадии злокачественного новообразования (метастатический рак)
- активное специальное лечение рака (химиотерапия, лучевая терапия и т.д.) на момент развития тромбофлебита.
УДД 5 УУР C [159]
- При наличии дополнительных факторов риска прогрессирования или рецидива ТФПВ рекомендуется рассмотреть вопрос о проведении продленной антикоагулянтной терапии с периодической оценкой целесообразности продления.
УДД 5 УУР C [159]
Комментарий. Сроки проведения контрольных осмотров и повторной оценки целесообразности продления антикоагуляции определяет специалист, проводящий лечение
3.1.8. Мигрирующий тромбофлебит, тромбофлебит Мондора
3.1.8.1. Мигрирующий тромбофлебит
Мигрирующий тромбофлебит - поражение поверхностных вен, при котором тромботический процесс затихает в одних и возникает в других участках венозной системы, часто отдаленных друг от друга. При этом реального перемещения (миграции) тромбов с места первичного поражения нет. Заболевание начинается с появления различной длины шнуровидного уплотнения в проекции подкожной вены одной локализации, затем тромбоз развивается в венах других анатомических зон, создавая впечатление миграции. Он словно "перескакивает" на новые области, нередко поражая вены верхних конечностей. Иногда одновременно возникает несколько очагов тромбозов.
- В случае мигрирующего тромбофлебита с целью оценки необходимости и проведения онкопоиска рекомендуется направить пациента к врачу общей практики, врачу-терапевту или к врачу-онкологу.
УДД 5 УУР С [167–169]
Комментарий. Мигрирующий тромбофлебит, ассоциированный с опухолью (синдром Труссо), рассматривается как вариант паранеопластического процесса. Синдром проявляется эпизодами воспаления сосудов с образованием в них тромбов, которые периодически повторяются и возникают в нехарактерных для ТФПВ местах, таких как туловище и верхние конечности. Этот синдром наиболее часто встречается при раке поджелудочной железы и легких [167–169] Таким образом, при обнаружении мигрирующего тромбофлебита целесообразным следует считать активный поиск онкологического заболевания. Мигрирующий тромбофлебит может быть проявлением болезни Бюргера (облитерирующего тромбангиита) [170,171].
3.1.8.2. Синдром Мондора (тромбофлебит Мондора)
Впервые описан автором в 1939 г. Представляет собой тромбоз поверхностных вен передней поверхности грудной клетки и живота [172,173]. Клинически проявляется болью и образованием тяжей в нижних отделах грудной стенки и/или по передне-латеральной поверхности брюшной стенки. Болезненность при пальпации сохраняется 3–7 дней, уплотнения – до нескольких месяцев, пигментация кожи и гиперестезия могут задерживаться на несколько месяцев; иногда в области бывшего поражения возникает казуистическая боль [173–176].
- В случае тромбофлебита Мондора с целью купирования симптомов заболевания и профилактики прогрессирования тромбоза рекомендуются НПВП системного действия (АТХ: M01A, нестероидные противовоспалительные и противоревматические препараты), НПВП для наружного применения (АТХ: M02AA нестероидные противовоспалительные препараты для местного применения) или антикоагулянты (АХТ: антитромботические средства).
УДД 5 УУР C [44,89,177]
3.2. Эластичная компрессия и локальная гипотермия
- Рекомендуется использовать эластичную компрессию (бандаж или медицинский компрессионный трикотаж с давлением 23—32 мм.рт.ст.) в стадию острого и стихающего ТФПВ в составе комплексного лечения ТФПВ для ускорения реканализации тромбированных вен и регресса тромботических масс.
УДД 2 УУР А [75]
Комментарий. В исследовании медицинский компрессионный трикотаж с давлением 23-32 мм.рт.ст. в течение 3-х недель в сочетании с профилактическими дозами НМГ не повлиял на скорость купирования боли, гиперемии, потребность в анальгетиках, уровень Д-димера, но способствовал более быстрому регрессу тромботических масс в течение первой недели ношения чулка [75]. Компрессионная терапия не может считаться самостоятельным методом лечения ТФПВ, но ее допустимо использовать в составе комплексного лечебного подхода.
- Рекомендуется использовать локальную гипотермию в составе комплексной терапии ТФПВ в стадию острого и стихающего ТФПВ с целью обезболивания и купирования местных симптомов воспаления.
УДД 5 УУР C [40,44,89,165]
3.3. Медикаментозная терапия
3.3.1. Антибиотики (Антибактериальные препараты системного действия, АТХ J01)
- Рутинное применение антибактериальных препаратов при ТФПВ не рекомендуется.
УДД 5 УУР C [61]
Комментарий. Ранняя эмпирическая антибактериальная терапия требуется при подозрении на гнойный тромбофлебит (см. п. 3.2.4.)
3.3.2. Нестероидные противовоспалительные и противоревматические препараты (АТХ M01A)
- С целью более быстрого купирования симптомов и проявлений в стадию острого или стихающего ТФПВ рекомендуется использовать краткосрочные курсы системных НПВП.
УДД 1 УУР А [60,69,70,78]
3.3.3. Антикоагулянты (препараты из группы АТХ B01A Антитромботические средства)
В версии рекомендаций, утвержденной МЗ РФ, наименование групп лекарственных препаратов дано в соответствии с классификацией АТХ. Согласно этой классификации, ацетилсалициловая кислота относится к группе антикоагулянтов. В связи со сложностью сопоставления классификации АТХ и принятого в клинической практике деления лекарственных препаратов по механизму действия и клиническим эффектам раздел «3.3.3. Антикоагулянты (препараты из группы АТХ B01A Антитромботические средства)» включает все антитромботические средства.
В качестве антитромботических средств при венозных тромбоэмболических осложнениях (ТГВ, ТЭЛА, ТФПВ) могут использоваться различные препараты (гепарин натрия**, НМГ, фондапаринукс натрия, антагонисты витамина К, ПОАК, ацетилсалициловая кислота и др.) Ниже представлены рекомендации по использованию отдельных препаратов при ТФПВ с целью профилактики прогрессирования тромбоза и развития тромбоэмболических осложнений).
3.3.3.1. Гепарин натрия** (антикоагулянты прямого действия, АТХ B01AB01)
- При выборе в качестве антитромботического средства #гепарина натрия** при ТФПВ рекомендуется использовать промежуточные (12500 ЕД 2 р/сутки п/к в течение недели и далее 10000 ЕД 2 р/сутки п/к) или профилактические (5000 ЕД 2 р/сутки п/к) дозы.
УДД 1 УУР А [69,97]
3.3.3.2. Гепарины низкомолекулярные (АТХ группа: B01AB Группа гепарина)
- При выборе в качестве антитромботического средства НМГ (АТХ группа: B01AB Группа гепарина) рекомендуется подкожное введение промежуточных доз (50—75% от лечебной дозы) #надропарина кальция (≥ 5700 МЕ 1 р. в день), #далтепарина натрия (≥ 5000 МЕ 1 р. в день), #эноксапарина натрия** (≥ 40 1 р. в день).
УДД 5 УУР С [60,69,70,85–87,178,179]
Комментарий. Промежуточные дозы НМГ (АТХ группа: B01AB Группа гепарина), приведены в Приложении А3.6 на основании данных систематического обзора с метаанализом их применения в клинической практике [179].
- При выборе в качестве антитромботического средства #парнапарина натрия** рекомендуется подкожное введение #парнапарина натрия** в дозе 8,500 МЕ 1 раз в сутки на протяжении 10 дней и далее 6,400 МЕ 1 раз в сутки.
УДД 2 УУР А [85]
Комментарий. В рекомендации указан режим максимальной эффективности #парнапарина натрия**, полученный в исследовании STEFLUX.
3.3.3.3. Фондапаринукс натрия (прочие антикоагулянты, АТХ B01AX)
- При выборе в качестве антитромботического средства #фондапаринукса натрия рекомендуется его подкожное введение в дозе 2,5 мг 1 раз в сутки
УДД 2 УУР A [84]
3.3.3.4. Прямые ингибиторы фактора Xa (АТХ B01AF)
- При выборе в качестве антитромботического средства прямых оральных антикоагулянтов (таблетированные препараты из группы АТХ: B01A Антитромботические средства) рекомендуется использовать #ривароксабан** в дозе 10 мг 1 раз в сутки.
УДД 2 УУР A [88]
Комментарий. На момент издания настоящих Рекомендаций в инструкциях к прямым оральным антикоагулянтам (таблетированные препараты из группы АТХ: B01A Антитромботические средства), зарегистрированным в Российской Федерации, в качестве показания к применению не указано лечение тромбофлебита поверхностных вен. Между тем, в рамках рандомизированного открытого сравнительного клинического исследования использование #ривароксабана** в дозе 10 мг на протяжении 45 дней оказалось не менее эффективным, чем подкожное введение #фондапаринукса натрия в дозе 2,5 мг 1 р/день при сравнении частоты регистрации симптоматического прогрессирования или рецидива ТФПВ, возникновения ТГВ и ТЭЛА, а также смерти от всех причин (ОР=1,9; 95% ДИ 0,6-6,4, p=0,0025 для дизайна «не хуже») [88]. Что касается больших и клинически значимых кровотечений, то частота их развития также не отличалась между группами.
3.3.3.5. Антагонисты витамина К (АТХ B01AA)
- Применение антагонистов витамина К в качестве антитромботического средства для лечения ТФПВ при доступности гепарина натрия**, НМГ, фондапаринукса натрия или ПОАК не рекомендуется.
УДД 1 УУР А [69,180]
Комментарий. АВК могут применяться в качестве основного антитромботического средства в лечении ТФПВ с целью профилактики прогрессирования тромбоза и развития ВТЭО по решению врача с учетом особенностей конкретного клинического случая. При наличии у пациента механического сердечного клапана, клапанной формы фибрилляции предсердий, СКФ менее 15 мл/мин, лактации, антифосфолипидном синдроме среди оральных антикоагулянтов (таблетированные препараты из группы АТХ: B01A Антитромботические средства) АВК являются препаратами выбора.
3.3.3.6. Салициловая кислота и ее производные (АТХ N02BA)
- Применение ацетилсалициловой кислоты** (АСК**) в качестве антитромботического средства для лечения ТФПВ не рекомендуется
УДД 2 УУР А [181,182]
Комментарий. Известно, что АСК** в дозе 100 мг обладает слабым проективным эффектом в рамках вторичной профилактики ТГВ и ТЭЛА после завершения стандартного курса антикоагулянтной терапии [181]. Этот эффект существенно уступает #ривароксабану** в дозе 10 мг и 20 мг при сходном профиле безопасности [182]. АСК** не может быть рекомендована для лечения острого эпизода ТФПВ или для предотвращения рецидива ТФПВ. В последнем случае АСК** может быть назначена в изученной дозировке (100 мг 1 раз в сутки) только при невозможности использования других антитромботических средств.
3.3.3.7. Сулодексид (группа: B01AB Группа гепарина)
- Применение сулодексида в качестве антитромботического средства для лечения ТФПВ не рекомендуется
УДД 5 УУР С [44,89,183]
Комментарий. На сегодняшний день имеются исследования по применению сулодексида в качестве антитромботического средства только для проведения продленной тромбопрофилактики при тромбозе глубоких вен нижних конечностей после курса лечения [183,184].
3.3.4. Ингибиторы ГМГ-КоА-редуктазы (АТХ C10AA)
- Применение ингибиторы ГМГ-КоА-редуктазы (статинов) в качестве антитромботического средства для лечения и вторичной профилактики ТФПВ и ВТЭО не рекомендуется
УДД 5 УУР С [185–188]
3.3.5. Биофлавоноиды (АТХ C05CA)
В версии рекомендаций, утвержденной МЗ РФ, наименование групп лекарственных препаратов дано в соответствии с классификацией АТХ. В связи со сложностью сопоставления классификации АТХ и принятого в клинической практике деления лекарственных препаратов по механизму действия и клиническим эффектам раздел «3.3.5. 3.3.5. Биофлавоноиды (АТХ C05CA)» ко всем веноактивным препаратам в общепринятом понимании этого термина.
- Рекомендуется применение биофлавоноидов только в стадию острого или стихающего ТФПВ с целью уменьшения боли и проявлений воспаления при информировании пациента об отсутствии прямых доказательств эффективности применения таких средств с указанной целью
УДД 5, УУР С [65]
Комментарий. Для веноактивных препаратов (АТХ: биофлавоноиды) показана эффективность в отношении уменьшения боли при остром геморрое [189]. В повседневной практике этот факт нередко экстраполируется на случаи ТФПВ [65]. Эффективность биофлавоноидов в отношении боли и проявлений воспаления при ТФПВ не изучена, однако, с учетом низкого риска развития неблагоприятных эффектов, экспертная группа считает допустимым их применение в комплексном лечении пациента с ТФПВ при соответствующем информировании пациента.
3.3.6. Препараты для местного применения
- С целью купирования местных симптомов воспаления в стадию острого или стихающего ТФПВ рекомендуется использование гепарин-содержащих препаратов для местного применения (АТХ группа: C05BA) (мази, гели) на основе НПВП и/или гепарина натрия** в составе комплексной терапии ТФПВ.
УДД 2, УУР А [74,80,82,190–192]
3.4. Хирургическое лечение
Цели хирургического лечения при ТФПВ:
- снижение риска развития ТЭЛА за счет разобщения вен в местах наиболее частого перехода тромбов из поверхностных вен в глубокие;
- снижение вероятности проксимального распространения тромбов по магистральным поверхностным венам и снижение риска рецидива тромбоза в несостоятельных магистральных поверхностных венах после отмены антикоагулянтов;
- частичное или полное удаление тромботических масс или тромбированных вен для ускорения регресса симптомов;
- уменьшение выраженности воспаления и ускорение регресса симптомов тромбофлебита при устранении патологического рефлюкса и кровенаполнения измененных вен;
Использование хирургических методов у пациентов с ТФПВ не может служить заменой терапевтических, в первую очередь, антикоагулянтных средств. По имеющимся данным, антикоагулянтная терапия не менее эффективна в снижении риска распространения тромба на глубокие вены и предотвращения ТЭЛА чем любой вид хирургического вмешательства.
3.4.1. Тактика хирургического лечения в зависимости от стадии ТФПВ
- В острую стадию ТФПВ рекомендуется выполнять только вмешательства, направленные на снижение риска ТЭЛА (кроссэктомия или приустьевая перевязка сафенной вены), а также на снижение проявлений воспаления.
УДД 5, УУР С [44,89,165]
- В стадию стихающего или стихшего ТФПВ рекомендуется выполнять только вмешательства, направленные на снижение риска распространения тромбоза по поверхностным венам или их тромбоза после отмены АКТ
УДД 5, УУР С [44,89,165,193]
Комментарий. К указанным вмешательствам относится термооблитерация не тромбированного несостоятельного сегмента магистральной поверхностной вены.
- Вмешательства, направленные на полную ликвидацию патологических рефлюксов и варикозно измененных поверхностных вен, рекомендуется проводить на стадии стихшего тромбофлебита или после перенесенного ТФПВ.
УДД 5, УУР С [40,44,45,89]
3.4.2. Приустьевая перевязка (высокое лигирование), кроссэктомия, тромбэктомия из глубоких вен
Кроссэктомия (операция Троянова-Тренделенбурга) - высокая (сразу у глубокой магистрали) перевязка большой (или малой) подкожной вены с обязательным лигированием всех приустьевых притоков и иссечением ствола поверхностной вены в пределах операционной раны. Для разобщения поверхностных и глубоких вен в области сафено-феморального или сафено-поплитеального соустий с целью предотвращения перехода тромба на глубокие вены возможна приустьевая перевязка магистральных поверхностных вен (высокое лигирование) или кроссэктомия.
УДД 4, УУР С [9,44,89,91]
- При высоком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ и выполнении приустьевой перевязки (высокого лигирования) или кроссэктомии в дополнение к антикоагуляции, рекомендуется применение после операции профилактических или промежуточных доз НМГ в течение 45 дней от начала ТФПВ
УДД 1, УУР А [69,90,180,194]
- При умеренном риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ рекомендуется выполнение высокого лигирования или кроссэктомии только при невозможности проведения АКТ.
УДД 1, УУР А [69,90,194]
Комментарий. Хирургическое вмешательство в сравнении с антикоагулянтной терапией ассоциируется с повышенной частотой развития осложнений (нагноение послеоперационной раны, кровотечение, ТГВ и ТЭЛА) при сходной вероятности прогрессирования ТФПВ [90]. В проспективном сравнительном нерандомизированном исследовании отечественных авторов сделан вывод: риск развития ТГВ и ТЭЛА при использовании антикоагулянтов в качестве основного метода не превышает таковой при использовании стандартного хирургического подхода, а частота осложнений у пациентов, перенесших оперативное вмешательство, существенно выше [194]. Таким образом, убедительных научных свидетельств преимуществ кроссэктомии в отношении предотвращения ТГВ и ТЭЛА не существует.
- При низком риске перехода тромба на глубокие вены вне зависимости от стадии ТФПВ не рекомендуется выполнение высокого лигирования или кроссэктомии
УДД 1, УУР С [44,69,89]
- Тромбэктомию из магистральных глубоких вен рекомендуется выполнить при распространении тромба за пределы сафено-феморального либо сафено-поплитеального соустья в тех случаях, когда принято решение о выполнении кроссэктомии/высокого лигирования.
УДД 4, УУР С [44,89,91]
Комментарий. Выбор доступа и метода тромбэктомии определяется уровнем расположения проксимальной части тромба. После освобождения соустья выполняют кроссэктомию.
3.4.3. Пункционная тромбэктомия
- Рекомендуется рассмотреть целесообразность выполнения пункционной тромбэктомии (флебоцентеза) из тромбированных подкожных вен как дополнения к медикаментозной терапии при выраженных признаках воспаления с целью ускорения их регресса в стадию острого ТФПВ
УДД 4, УУР С [195]
3.4.4. Эндовенозная термооблитерация
- В стадию стихающего или стихшего тромбофлебита, или после перенесенного ТФПВ, рекомендуется рассмотреть целесообразность выполнения эндовенозной термооблитерации несостоятельных участков сафенных вен с целью предотвращения распространения тромбоза по поверхностным венам или предотвращения их тромбоза после отмены АКТ.
УДД 4, УУР С [193,196,197]
Комментарий. Сведения об эффективности и безопасности термооблитерации проксимального отдела ствола БПВ и МПВ на стадии острого ТФПВ весьма ограничены [193,196,197]. На сегодняшний день недостаточно данных для вывода о целесообразности использования термооблитерации в целях предотвращения перехода тромботического процесса в глубокую венозную систему. В связи с этим, нет оснований считать ТФПВ показанием для выполнения эндовазальной термооблитерации.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
После тромбофлебита поверхностных вен специфическая реабилитация не требуется. Уплотнения в зонах расположения тромбированных поверхностных вен и симптомы могут сохраняться в течение нескольких месяцев (6 мес. и более).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Диспансерное наблюдение
Перенесенный ТФПВ не требует диспансерного наблюдения. В случае варикотромбофлебита должна быть рассмотрена возможность проведения лечения по устранению варикозного расширения вен.
5.2. Профилактика первого эпизода ТФПВ
- С целью профилактики первого эпизода варикотромбофлебита рекомендуется ликвидация патологических рефлюксов и варикозно измененных поверхностных вен в плановом порядке с учетом баланса рисков, ассоциированных с вмешательством, и риска развития ВТЭО.
УДД 4, УУР С [44,89,198,199]
- Рекомендуется рассмотреть применение эластичного компрессионного трикотажа с давлением у лодыжки 10 – 30 мм.рт.ст. с целью профилактики бессимптомных ТГВ, ТФПВ и отеков при длительных перелетах (продолжительность перелета свыше 5 часов)
УДД 1, УУР А [200]
5.3. Профилактика рецидива ТФПВ
- С целью профилактики рецидива варикотромбофлебита рекомендуется ликвидация патологических рефлюксов и варикозно измененных поверхностных вен в плановом порядке на стадии стихшего тромбофлебита или после перенесенного ТФПВ.
УДД 4, УУР С [44,89,198,199]
- С целью профилактики рецидива ВТЭО при рецидивирующем ТФПВ (2 и более эпизодов) рекомендуется рассмотреть целесообразность продленной тромбопрофилактики.
УДД 3, УУР B [201]
при рецидивирующем ТФПВ рекомендуется применение #ривароксабана** 10 мг в сутки, или #сулодексида 250 ЛЕ 2 раза в сутки или #ацетилсалициловую кислоту** 100 мг в сутки неопределенно долго с регулярной оценкой пользы и риска дальнейшего продления.
УДД 5, УУР С [44,89,182–184,202–205]
Комментарий. На сегодняшний день отсутствуют исследования по продленной тромбопрофилактике при ТФПВ. ТФПВ с высоким риском рецидива рассматривается как вариант венозного тромбоэмболического осложнения, возможно требующий продленной тромбопрофилактики. В данной рекомендации использована экстраполяция способов продленной тромбопрофилактики при тромбозе глубоких вен нижних конечностей, как более изученной формы ВТЭО [182,184,202].
6. Организация оказания медицинской помощи
Показаниями к госпитализации при тромбозе поверхностных вен являются высокий риск перехода тромба на глубокие вены в стадию острого ТФПВ и гнойный тромбофлебит.
Во всех остальных случаях решение о госпитализации должно приниматься индивидуально с учетом риска прогрессирования тромбоза и развития тромбоэмболии легочных артерий, стадии заболевания, возможностей проведения адекватной терапии в амбулаторных условиях, приверженности пациента назначениям, а также возможности динамического клинического и ультразвукового контроля за течением заболевания. Оценка перечисленных и других факторов, способных повлиять на исход заболевания, проводится лечащим специалистом индивидуально, в том числе в случаях симультанного тромбоза глубоких вен или при переходе тромба на глубокие вены. При подозрении на развитие ГТ необходимо госпитализировать пациента и дальнейшие диагностические и лечебные мероприятия проводить в условиях стационара.
При невозможности выполнения ДСВНК у пациентов с острой стадией ТФПВ с клиническими признаками острого воспаления, достигающими средней трети бедра в системе БПВ и/или верхней трети голени в системе МПВ, рекомендуется госпитализировать пациента.
Наличие хотя бы одного фактора риска геморрагических осложнений по критериям RCOG/РОАГ (Приложение А3.1) является серьезным аргументом для госпитализации при ТФПВ во время беременности и в послеродовом периоде. Во время беременности и в послеродовом периоде действительны также общие для пациентов с ТФПВ показания к госпитализации: высокий риск перехода тромба на глубокие вены в острый период ТФПВ; гнойный тромбофлебит; невозможность ДСВНК у пациентов с острой стадией ТФПВ с клиническими признаками острого воспаления, достигающими средней трети бедра в системе БПВ и/или верхней трети голени в системе МПВ.
Показанием к выписке из стационара является отсутствие прогрессирования ТФПВ и стихание проявлений острого воспаления на фоне проводимой антикоагулянтной или симптоматической терапии.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- К дополнительным факторам риска ВТЭО, ассоциированным с увеличенной вероятностью выявления ТГВ/ТЭЛА на момент диагностики ТФПВ, рекомендуется относить: мужской пол, личный или семейный анамнез ВТЭО, возраст старше 75 лет, наличие неизлеченного рака, наличие системного воспалительного заболевания, госпитализацию пациента, тромбоз неварикозных вен [36].
- К дополнительным факторам риска рецидива ТФПВ или его прогрессирования с развитием ТГВ/ТЭЛА в течение 3 мес после диагностики рекомендуется относить: мужской пол, личный или семейный анамнез ВТЭО, рак в анамнезе, стационарное лечение, тромбоз неварикозных вен, давность симптомов менее 7 суток, тяжелую форму венозной недостаточности, избыточную массу тела [33,36,38,39].
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
УДД |
УУР |
|
Этап постановки диагноза |
|||
|
1 |
Выполнено клиническое обследование пациента (выявление веноспецифических жалоб, сбор анамнеза, осмотр, пальпация нижних конечностей). |
5 |
С |
|
2 |
Определена стадия ТФПВ и степень риска перехода тромба на глубокие вены |
5 |
С |
|
3 |
Проведено ультразвуковое дуплексное сканирование вен нижних конечностей с оценкой состояния поверхностных и глубоких вен обеих нижних конечностей |
4 |
С |
|
Этап консервативного и хирургического лечения |
|||
|
1 |
При умеренном и высоком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ проведена антикоагулянтная терапия |
3 |
B |
|
2 |
При высоком риске перехода тромба на глубокие вены в стадию острого и стихающего ТФПВ и невозможности антикоагулянтной терапии выполнена приустьевая перевязка (высокое лигирование) или кроссэктомия |
5 |
C |
|
Этап контроля |
|||
|
10 |
При отсутствии положительной динамики клинических проявлений ТВПФ на фоне проводимого лечения выполнено повторное ультразвуковое дуплексное сканирование вен нижних конечностей |
5 |
C |
Список литературы
- Meissner M.H., Wakefield T.W., Ascher E., Caprini J. a, Comerota A.J., Eklof B., Gillespie D.L., Greenfield L.J., He A.R., Henke P.K., Hingorani A., Hull R.D., Kessler C.M., McBane R.D., McLafferty R. Acute venous disease: venous thrombosis and venous trauma. // J Vasc Surg. 2007. Vol. 46 Suppl S. P. 25S-53S.
- Gillet J.L., Perrin M., Cayman R. [Superficial venous thrombosis of the lower limbs: prospective analysis in 100 patients](Article in French) // J Mal Vasc. 2001. Vol. 26, № 1. P. 16–22.
- Leon L., Giannoukas A.D., Dodd D., Chan P., Labropoulos N. Clinical Significance of Superficial Vein Thrombosis // Eur J Vasc Endovasc Surg. 2005. Vol. 29, № 1. P. 10–17.
- Blättler, Schwarzenbach, Largiadèr. Superficial vein thrombophlebitis–serious concern or much ado about little? // VASA. 2008. Vol. 37, № 1. P. 31–38.
- Decousus H., Frappé P., Accassat S., Bertoletti L., Buchmuller A., Seffert B., Merah A., Becker F., Queré I., Leizorovicz A. Epidemiology, diagnosis, treatment and management of superficial-vein thrombosis of the legs // Best Pr. Res Clin Haematol. 2012. Vol. 25, № 3. P. 275–284.
- Савельев В.С., Кириенко А.И., Золотухин И.А., Селиверстов Е.И. Проспективное обсервационное исследование СПЕКТР: регистр пациентов с хроническими заболеваниями вен нижних конечностей // Флебология. 2012. Vol. 6, № 1. P. 4–9.
- Jacobsen A.F., Skjeldestad F.E., Sandset P.M. Ante- and postnatal risk factors of venous thrombosis: a hospital-based case-control study. // J Thromb Haemost. England, 2008. Vol. 6, № 6. P. 905–912.
- Barrellier M.T. [Superficial venous thromboses of the legs](Article in French) // Phlebologie. France, 1993. Vol. 46, № 4. P. 633–639.
- Krause U., Kock H.J., Kröger K., Albrecht K., Rudofsky G. Prevention of deep venous thrombosis associated with superficial thrombophlebitis of the leg by early saphenous vein ligation. // VASA. Switzerland, 1998. Vol. 27, № 1. P. 34–38.
- Mouton W.G., Kienle Y., Muggli B., Naef M., Wagner H.E. Tumors associated with superficial thrombophlebitis. // VASA. Switzerland, 2009. Vol. 38, № 2. P. 167–170.
- Engesser L., Broekmans A.W., Briët E., Brommer E.J., Bertina R.M. Hereditary protein S deficiency: clinical manifestations. // Ann Intern Med. United States, 1987. Vol. 106, № 5. P. 677–682.
- Pabinger I., Schneider B. Thrombotic risk in hereditary antithrombin III, protein C, or protein S deficiency. A cooperative, retrospective study. Gesellschaft fur Thrombose- und Hamostaseforschung (GTH) Study Group on Natural Inhibitors. // Arter. Thromb Vasc Biol. United States, 1996. Vol. 16, № 6. P. 742–748.
- Karathanos C., Spanos K., Saleptsis V., Tsezou A., Kyriakou D., Giannoukas A.D. Recurrence of superficial vein thrombosis in patients with varicose veins. // Phlebology. England, 2016. Vol. 31, № 7. P. 489–495.
- de Moerloose P., Wutschert R., Heinzmann M., Perneger T., Reber G., Bounameaux H. Superficial vein thrombosis of lower limbs: influence of factor V Leiden, factor II G20210A and overweight. // Thromb Haemost. 1998. Vol. 80, № 2. P. 239–241.
- Hanson J.N., Ascher E., DePippo P., Lorensen E., Scheinman M., Yorkovich W., Hingorani A. Saphenous vein thrombophlebitis (SVT): a deceptively benign disease. // J Vasc Surg. 1998. Vol. 27, № 4. P. 677–680.
- Martinelli I., Cattaneo M., Taioli E., De Stefano V., Chiusolo P., Mannucci P.M. Genetic risk factors for superficial vein thrombosis. // Thromb Haemost. 1999. Vol. 82, № 4. P. 1215–1217.
- Schönauer V., Kyrle P.A., Weltermann A., Minar E., Bialonczyk C., Hirschl M., Quehenberger P., Schneider B., Partsch H., Eichinger S. Superficial thrombophlebitis and risk for recurrent venous thromboembolism. // J Vasc Surg. United States, 2003. Vol. 37, № 4. P. 834–838.
- de Godoy J.M.P., Braile D.M. Protein S deficiency in repetitive superficial thrombophlebitis. // Clin Appl Thromb Hemost. United States, 2003. Vol. 9, № 1. P. 61–62.
- van Langevelde K., Lijfering W.M., Rosendaal F.R., Cannegieter S.C. Increased risk of venous thrombosis in persons with clinically diagnosed superficial vein thrombosis: results from the MEGA study. // Blood. United States, 2011. Vol. 118, № 15. P. 4239–4241.
- Legnani C., Cini M., Cosmi B., Filippini M., Favaretto E., Palareti G. Inherited and acquired thrombophilic alterations in patients with superficial vein thrombosis of lower limbs. // Thromb Haemost. Germany, 2014. Vol. 111, № 6. P. 1194–1196.
- Karathanos C., Exarchou M., Tsezou A., Kyriakou D., Wittens C., Giannoukas A. Factors associated with the development of superficial vein thrombosis in patients with varicose veins. // Thromb Res. United States, 2013. Vol. 132, № 1. P. 47–50.
- de Godoy J.M., Batigália F., Braile D.M. Superficial thrombophlebitis and anticardiolipin antibodies--report of association. // Angiology. 2001. Vol. 52, № 2. P. 127–129.
- Di Minno M.N.D., Ambrosino P., Ambrosini F., Tremoli E., Di Minno G., Dentali F. Prevalence of deep vein thrombosis and pulmonary embolism in patients with superficial vein thrombosis: a systematic review and meta-analysis // J Thromb Haemost. 2016. Vol. 14, № 5. P. 964–972.
- Chengelis D.L., Bendick P.J., Glover J.L., Brown O.W., Ranval T.J. Progression of superficial venous thrombosis to deep vein thrombosis. // J Vasc Surg. 1996. Vol. 24, № 5. P. 745–749.
- Blumenberg R.M., Barton E., Gelfand M.L., Skudder P., Brennan J. Occult deep venous thrombosis complicating superficial thrombophlebitis. // J Vasc Surg. 1998. Vol. 27, № 2. P. 338–343.
- Dalsing M.C. The Case Against Anticoagulation for Superficial Venous Thrombosis // Dis Mon. 2010. Vol. 56, № 10. P. 582–589.
- Leizorovicz A., Becker F., Buchmüller A., Quéré I., Prandoni P., Decousus H. Clinical relevance of symptomatic superficial-vein thrombosis extension: lessons from the CALISTO study // Blood. 2013. Vol. 122, № 10. P. 1724–1729.
- Гаврилов С., Золотхин И., Пустовойт А. Приустьевая перевязка магистральной подкожной вены по поводу острого восходящего тромбофлебита // Флебология. 2011. Vol. 5, № 4. P. 88–90.
- Frappé P., Buchmuller-Cordier A., Bertoletti L., Bonithon-Kopp C., Couzan S., Lafond P., Leizorovicz A., Merah A., Presles E., Preynat P., Tardy B., Décousus H., STEPH Study Group. Annual diagnosis rate of superficial vein thrombosis of the lower limbs: the STEPH community-based study. // J Thromb Haemost. 2014. Vol. 12, № 6. P. 831–838.
- Coon W.W., Willis P.W. 3rd, Keller J.B. Venous thromboembolism and other venous disease in the Tecumseh community health study. // Circulation. United States, 1973. Vol. 48, № 4. P. 839–846.
- Superficial thrombophlebitis // Handb. Venous Lymphat. Disord. 4th ed. / ed. Gloviczki P. CRC Press, 2017. P. 343–347.
- Lutter K.S., Kerr T.M., Roedersheimer L.R., Lohr J.M., Sampson M.G., Cranley J.J. Superficial thrombophlebitis diagnosed by duplex scanning. // Surgery. 1991. Vol. 110, № 1. P. 42–46.
- Decousus H., Quéré I., Presles E., Becker F., Barrellier M.-T., Chanut M., Gillet J.-L., Guenneguez H., Leandri C., Mismetti P., Pichot O., Leizorovicz A. Superficial venous thrombosis and venous thromboembolism: a large, prospective epidemiologic study. // Ann Intern Med. 2010. Vol. 152, № 4. P. 218–224.
- Kudlaty E., Oriowo B., Yang M.J., Go M.R., Satiani B. Isolated Great Saphenous Vein Thrombus Is Associated with High Rates of Complications regardless of Management // Ann Vasc Surg. 2017. Vol. 45. P. 154–159.
- Binder B., Lackner H.K., Salmhofer W., Kroemer S., Custovic J., Hofmann-Wellenhof R. Association between superficial vein thrombosis and deep vein thrombosis of the lower extremities // Arch Dermatol. 2009. Vol. 145, № 7. P. 753–757.
- Galanaud J.P., Genty C., Sevestre M.A., Brisot D., Lausecker M., Gillet J.L., Rolland C., Righini M., Leftheriotis G., Bosson J.L., Quere I. Predictive factors for concurrent deep-vein thrombosis and symptomatic venous thromboembolic recurrence in case of superficial venous thrombosis: The OPTIMEV study // Thromb Haemost. 2011. Vol. 105, № 1. P. 31–39.
- Cannegieter S.C., Horváth-Puhó E., Schmidt M., Dekkers O.M., Pedersen L., Vandenbroucke J.P., Sørensen H.T. Risk of venous and arterial thrombotic events in patients diagnosed with superficial vein thrombosis: A nationwide cohort study // Blood. American Society of Hematology, 2015. Vol. 125, № 2. P. 229–235.
- Galanaud J.P., Bosson J.L., Genty C., Presles E. Superficial vein thrombosis and recurrent venous thromboembolism : a pooled analysis of two observational studies // J Thromb Haemost. 2012. P. 1004–1011.
- Quenet S., Laporte S., Décousus H., Leizorovicz A., Epinat M., Mismetti P. Factors predictive of venous thrombotic complications in patients with isolated superficial vein thrombosis // J Vasc Surg. Mosby Inc., 2003. Vol. 38, № 5. P. 944–949.
- Кириенко А., Матюшенко А., Андрияшкин В. Острый тромбофлебит. ЛитТерра, 2006. 109 p.
- Marković M.D., Lotina S.I., Davidović L.B., Vojnović B.R., Kostić D.M., Cinara I.S., Svetković S.D. [Acute superficial thrombophlebitis--modern diagnosis and therapy](Article in Serbian) // Srp Arh Celok Lek. Vol. 125, № 9–10. P. 261–266.
- Bauersachs R.M. Diagnosis and treatment of superficial vein thrombosis // Hamostaseologie. 2013. Vol. 33, № 3. P. 232–240.
- Nasr H., Scriven J.M. Superficial thrombophlebitis (superficial venous thrombosis). // BMJ. 2015. P. 350:h2039.
- Стойко Ю.М., Кириенко А.И., Илюхин Е.А., Лобастов К.В., Чаббаров Р.Г., Париков М.А., Хорев Н.Г., Золотухин И.А., Андрияшкин В.В., Карпенко А.А., Фокин А.А., Сушков С.А., Сапелкин С.В., Сучков И.А., Крылов А.Ю., Игнатьев И.М. Диагностика и лечение тромбофлебита поверхностных вен конечностей . Рекомендации Ассоциации флебологов России // Флебология. 2019. Vol. 13, № 2. P. 78–97.
- Шевченко Ю.Л., Стойко Ю.М. Клиническая флебология. ДПК Пресс, 2016. 256 p.
- Савельев В.С., Гологорский В.А., Кириенко А.И., Алексперова Т.В., Андрияшкин В.В., Богачев В.Ю., Богданец Л.И., Вирганский А.О., Гельфанд Б.Р., Гологорский В.А., Григорян Р.А., Гриненко Т.Ф., Золотухин И.А., Капранов С.А., Леонтьев С.Г., Матюшенко А.А., Прокубовский В.И. Флебология: руководство для врачей // М. Медицина / ed. Савельев В.С. М: Медицина, 2001. 664 p.
- Caprini, Goldshteyn, Glase, Hathaway. Thrombophilia testing in patients with venous thrombosis // Eur J Vasc Endovasc Surg. Eur J Vasc Endovasc Surg, 2005. Vol. 30, № 5. P. 550–555.
- Karathanos C., Sfyroeras G., Drakou A., Roussas N., Exarchou M., Kyriakou D., Giannoukas A. Superficial vein thrombosis in patients with varicose veins: role of thrombophilia factors, age and body mass // Eur J Vasc Endovasc Surg. Eur J Vasc Endovasc Surg, 2012. Vol. 43, № 3. P. 355–358.
- Kalodiki E., Stvrtinova V., Allegra C., Andreozzi G., Antignani P.L., Avram R., Brkljacic B., Cadariou F., Dzsinich C., Fareed J. Superficial vein thrombosis: a consensus statement // Int Angiol. 2012. Vol. 31, № 3. P. 203–216.
- Zygmunt J.A. Duplex ultrasound for chronic venous insufficiency. // J Invasive Cardiol. 2014. Vol. 26, № 11. P. E149-55.
- Smith Z.T., Bagley A.R., Guy D., Preston L., Ali N.S. Ultrasound Imaging of Superficial Venous Thrombosis in the Upper and Lower Extremities: Closing the Gap Between Clinical Management Guidelines and Ultrasound Practice Parameters // J Ultrasound Med. 2021. P. 1–8.
- Madhusudhana S., Moore A., Moormeier J.A. Current issues in the diagnosis and management of deep vein thrombosis // Mo Med. 2009. Vol. 106, № 1. P. 43–48.
- Lim K.E., Hsu W.C., Hsu Y.Y., Chu P.H., Ng C.J. Deep venous thrombosis: Comparison of indirect multidetector CT venography and sonography of lower extremities in 26 patients // Clin Imaging. Elsevier Inc., 2004. Vol. 28, № 6. P. 439–444.
- Maki D.D., Kumar N., Nguyen B., Langer J.E., Miller J., Gefter W.B. Distribution of thrombi in acute lower extremity deep venous thrombosis: Implications for sonography and CT and MR venography // AJR Am J Roentgenol. American Roentgen Ray Society, 2000. Vol. 175, № 5. P. 1299–1301.
- Carpenter J., Holland G., Baum R., Owen R., Carpenter J., Cope C. Magnetic resonance venography for the detection of deep venous thrombosis: comparison with contrast venography and duplex Doppler ultrasonography // J Vasc Surg. J Vasc Surg, 1993. Vol. 18, № 5. P. 734–741.
- Duwe K., Shiau M., Budorick N., Austin J., Berkmen Y. Evaluation of the lower extremity veins in patients with suspected pulmonary embolism: a retrospective comparison of helical CT venography and sonography. 2000 ARRS Executive Council Award I. American Roentgen Ray Society // AJR Am J Roentgenol. AJR Am J Roentgenol, 2000. Vol. 175, № 6. P. 1525–1531.
- Илюхин Е.А., Демехова М.Ю., Шонов О.А., Золотухин И.А. Индивидуальная оценка пользы и риска вторичной профилактики венозных тромбоэмболических осложнений антикоагулянтами // Флебология. 2014. Vol. 4, № 8. P. 42–54.
- Kearon C., Akl E.A., Ornelas J., Blaivas A., Jimenez D., Bounameaux H., Huisman M., King C.S., Morris T.A., Sood N., Stevens S.M., Vintch J.R.E., Wells P., Woller S.C., Moores L. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report // Chest. Elsevier Ltd, 2016. Vol. 149, № 2. P. 315–352.
- Uncu H. A comparison of low-molecular-weight heparin and combined therapy of low-molecular-weight heparin with an anti-inflammatory agent in the treatment of superficial vein thrombosis // Phlebology. 2009. Vol. 24, № 2. P. 56–60.
- The Superficial Thrombophlebitis Treated by Enoxaparin Study Group. A pilot randomized double-blind comparison of a low-molecular-weight heparin, a nonsteroidal anti-inflammatory agent, and placebo in the treatment of superficial vein thrombosis // Arch Intern Med. 2003. Vol. 163, № 14. P. 1657–1663.
- Cesarone M.R., et al. Management of Superficial Vein Thrombosis and Thrombophlebitis: Status and Expert Opinion Document // Angiology. 2007. Vol. 58, № 1S. P. 7S--14S.
- Maeseneer M.G.R. De. Superficial Thrombophlebitis of the Lower Limb : Practical Recommendations for Diagnosis and Treatment Superficial Thrombophlebitis of the Lower Limb : Practical Recommendations // Acta Chir Belg. 2016. № March. P. 145–147.
- Sharma A. Effectiveness of Cold Application, Heparinoid Application and Megnesium-sulphate Application on Superficial Thrombophlebitis-Literature Review // Int. J. Nurs. Educ. Diva Enterprises Private Limited, 2016. Vol. 8, № 2. P. 1.
- Sharma A. A comparative study to assess the effectiveness of cold application heparinoid application and magnesium sulphate application on superficial thrombophlebitis among patients admitted in selected hospital of Gujarat // Int. J. Nurs. Educ. 2016. Vol. 8. P. 118–121.
- Кириенко А.И. Острый варикотромбофлебит: диагностика, основные принципы лечения и профилактика // РМЖ. 1999. Vol. 13. P. 600.
- Quenet S., Laroche L., Bertoletti L., Quéré I., Décousus H., Becker F., Leizorovicz A. Value of a Planned Compression Ultrasonography after an Isolated Superficial Vein Thrombosis: Results from a Prospective Multicentre Study // Eur J VascEndovasc Surg. 2011. Vol. 43. P. 233–237.
- Kakkos S.K., et al. European Society for Vascular Surgery (ESVS) 2021 Clinical Practice Guidelines on the Management of Venous Thrombosis // Eur J Vasc Endovasc Surg. W.B. Saunders Ltd, 2021. Vol. 61, № 1. P. 9–82.
- Cosmi B. Management of superficial vein thrombosis // J Thromb Haemost. 2015. Vol. 13, № 7. P. 1175–1183.
- Di Nisio M., Wichers I.M., Middeldorp S. Treatment for superficial thrombophlebitis of the leg // Cochrane Database Syst Rev. John Wiley and Sons Ltd, 2018. Vol. 2, № 2. P. CD004982.
- Rathbun S.W., Aston C.E., Whitsett T.L. A randomized trial of dalteparin compared with ibuprofen for the treatment of superficial thrombophlebitis // J Thromb Haemost. Blackwell Publishing Ltd, 2012. Vol. 10, № 5. P. 833–839.
- Ferrari E., Pratesi C., Scaricabarozzi I. A comparison of nimesulide and diclofenac in the treatment of acute superficial thrombophlebitis // Drugs. 1993. Vol. 46, № 1. P. 197–199.
- Agus G.B., De Angelis R., Mondani P., Moia R. Double-blind comparison of nimesulide and diclofenac in the treatment of superficial thrombophlebitis with telethermographic assessment // Drugs. 1993. Vol. 46, № 1. P. 200–203.
- Katzenschlager R., Hirschl M., Minar E., Ugurluoglu A. Liposomal heparin-spraygel in comparison with subcutaneous low molecular weight heparin in patients with superficial venous thrombosis. A randomized, controlled, open multicentre study // J. fur Kardiol. 2003. Vol. 10, № 9. P. 375–378.
- Becherucci A., Bagilet D., Marenghini J., Diab M., Biancardi H. [Effect of topical and oral diclofenac on superficial thrombophlebitis caused by intravenous infusion](Article in Spanish) // Med Clin. 2000. Vol. 114, № 10. P. 371–373.
- Boehler K., Kittler H., Stolkovich S., Tzaneva S. Therapeutic Effect of Compression Stockings Versus no Compression on Isolated Superficial Vein Thrombosis of the Legs: A Randomized Clinical Trial // Eur J Vasc Endovasc Surg. Elsevier, 2014. Vol. 48, № 4. P. 465–471.
- De Sanctis M.T., Cesarone M.R., Incandela L., Belcaro G., Griffin M. Treatment of Superficial Vein Thrombosis with Standardized Application of Essaven Gel Placebo-Controlled , Randomized Study // Angiology. 2001. Vol. 52, № 3_suppl. P. S57–S62.
- Incandela L., De Sanctis M.T., Cesarone M.R., Ricci A., Errichi B.M., Dugal M., Belcaro G., Griffin M. Treatment of superficial vein thrombosis: clinical evaluation of Essaven gel--a placebo-controlled, 8-week, randomized study. // Angiology. United States, 2001. Vol. 52 Suppl 3. P. S69-72.
- No authors listed. Indomethacin in superficial thrombophlebitis // Practitioner. 1970/09/01. 1970. Vol. 205, № 227. P. 369–372.
- Górski G., Szopiński P., Michalak J., Marianowska A., Borkowski M., Geremek M., Trochimczuk M., Brotánek J., Sárník S., Seménka J. Liposomal heparin spray: a new formula in adjunctive treatment of superficial venous thrombosis // Angiology. 2005. Vol. 56, № 1. P. 9–17.
- Villardell M., Sabat D., Arnaiz J.A., Bleda M.J., Castel J.M., Laporte J.R., Vallvé C. Topical heparin for the treatment of acute superficial phlebitis secondary to indwelling intravenous catheter A double-blind, randomized, placebo-controlled trial // Eur J Clin Pharmacol. 1999. Vol. 54, № 12. P. 917–921.
- Bergqvist D., Brunkwall J., Jensen N., Persson N.H. Treatment of superficial thrombophlebitis. A comparative trial between placebo, Hirudoid cream and piroxicam gel // Ann Chir Gynaecol. 1990. Vol. 79, № 2. P. 92–96.
- Belcaro G., Cesarone M.R., Dugall M., Feragalli B., Ippolito E., Corsi M., Hosoi M., Cornelli U., Ledda A., Gizzi G. Topical formulation of heparin is effective in reducing the symptoms of superficial venous thrombosis: a monocenter, observer-blind, placebo-controlled randomized study // Panminerva Med. 2011. Vol. 53, № 3 Suppl 1. P. 3–11.
- Золкин В.Н., Тищенко И.С. Антикоагулянтная терапия в лечении острых тромбозов глубоких и поверхностных вен нижних конечностей // Трудный пациент. 2007. Vol. 5, № 15–16. P. 11–15.
- Decousus H., Prandoni P., Mismetti P., Bauersachs R.M., Boda Z., Brenner B., Laporte S., Matyas L., Middeldorp S., Sokurenko G. Fondaparinux for the treatment of superficial-vein thrombosis in the legs // N Engl J Med. 2010. Vol. 363, № 13. P. 1222–1232.
- Cosmi B., et al. A randomized double-blind study of low-molecular-weight heparin (parnaparin) for superficial vein thrombosis: STEFLUX (Superficial ThromboEmbolism and Fluxum) // J Thromb Haemost. 2012.
- The Vesalio Investigators G. High vs. low doses of low-molecular-weight heparin for the treatment of superficial vein thrombosis of the legs: a double-blind, randomized trial // J Thromb Haemost. Blackwell Science Inc, 2005. Vol. 3, № 6. P. 1152–1157.
- Titon J.P., Auger D., Grange P., Hecquet J.P., Remond A., Ulliac P., Vaissie J.J. [Therapeutic management of superficial venous thrombosis with calcium nadroparin. Dosage testing and comparison with a non-steroidal anti-inflammatory agent](Article in French) // Ann Cardiol Angeiol. 1994/03/01. 1994. Vol. 43, № 3. P. 160–166.
- Beyer-Westendorf J., Schellong S.M., Gerlach H., Rabe E., Weitz J.I., Jersemann K., Sahin K., Bauersachs R., SURPRISE investigators. Prevention of thromboembolic complications in patients with superficial-vein thrombosis given rivaroxaban or fondaparinux: the open-label, randomised, non-inferiority SURPRISE phase 3b trial // Lancet Haematol. 2017. Vol. 4, № 3. P. e105–e113.
- Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология. 2015. Vol. 4, № 2. P. 2–25.
- Sullivan V., Denk P.M., Sonnad S.S., Eagleton M.J., Wakefield T.W. Ligation versus anticoagulation: treatment of above-knee superficial thrombophlebitis not involving the deep venous system // J Am Coll Surg. 2001. Vol. 193, № 5. P. 556–562.
- Rohrbach N., Mouton W., Naef M., Otten K., Zehnder T., Wagner H. Morbidity in superficial thrombophlebitis and its potential surgical prevention // Swiss Surg. Swiss Surg, 2003. Vol. 9, № 1. P. 15–17.
- Davidson, Verheijen, Lensing, Gebel, Brighton, Lyons, Rehm, Prins. Bleeding risk of patients with acute venous thromboembolism taking nonsteroidal anti-inflammatory drugs or aspirin // JAMA Intern Med. JAMA Intern Med, 2014. Vol. 174, № 6. P. 947–953.
- Фронек Х.С. Заболевания вен / ed. Золотухин И.А. М.: ГЭОТАР-Медиа, 2010. 208 p.
- Giannoukas A., Karathanos C., Nikolakopoulos K., Georgiadis G.S., Maltezos C., Ioannou C., Vasdekis S., Trelopoulos G. Tinzaparin in intermediate dose for the treatment of superficial vein thrombosis: Results from an observational multicenter study-SeVEN study. // Phlebology. England, 2018. Vol. 33, № 9. P. 636–645.
- Quenet S., Laroche J.P., Bertoletti L., Quéré I., Décousus H., Becker F., Leizorovicz A. Value of a planned compression ultrasonography after an isolated superficial vein thrombosis: Results from a prospective multicentre study // Eur J Vasc Endovasc Surg. 2012. Vol. 43, № 2. P. 233–237.
- Wichers I., Di Nisio M., Büller H., Middeldorp S. Treatment of superficial vein thrombosis to prevent deep vein thrombosis and pulmonary embolism: a systematic review // Haematologica. 2005. Vol. 5. P. 672–677.
- Marchiori A., Verlato F., Sabbion P., Camporese G., Rosso F., Mosena L., Andreozzi G.M., Prandoni P. High versus low doses of unfractionated heparin for the treatment of superficial thrombophlebitis of the leg. A prospective, controlled, randomized study // Haematologica. 2002. Vol. 87, № 5. P. 523–527.
- Kearon C., Akl E.A., Comerota A.J., Prandoni P., Bounameaux H., Goldhaber S.Z., Nelson M.E., Wells P.S., Gould M.K., Dentali F., Crowther M., Kahn S.R. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. American College of Chest Physicians, 2012. Vol. 141, № 2 Suppl. P. e419S-94S.
- Decousus H., Quéré I., Presles E., Becker F., Barrellier M.-T., Chanut M., Gillet J.-L., Guenneguez H., Leandri C., Mismetti P., Pichot O., Leizorovicz A. Superficial venous thrombosis and venous thromboembolism: a large, prospective epidemiologic study. // Ann Intern Med. 2010. Vol. 152, № 4. P. 218–224.
- Cosmi B., Filippini M., Campana F., Avruscio G., Ghirarduzzi A., Bucherini E., Camporese G., Imberti D., Legnani C., Palareti G. Risk factors for recurrent events in subjects with superficial vein thrombosis in the randomized clinical trial SteFlux (Superficial Thromboembolism Fluxum) // Thromb. Res. Elsevier Ltd, 2014. Vol. 133, № 2. P. 196–202.
- Barco S., Pomero F., Di Minno M.N.D., Tamborini Permunian E., Malato A., Pasca S., Barillari G., Fenoglio L., Siragusa S., Di Minno G., Ageno W., Dentali F. Clinical course of patients with symptomatic isolated superficial vein thrombosis: the ICARO follow-up study. // J Thromb Haemost. England, 2017. Vol. 15, № 11. P. 2176–2183.
- Di Nisio M., Peinemann F., Porreca E., Rutjes A.W. Treatment for superficial infusion thrombophlebitis of the upper extremity // Cochrane Database Syst Rev / ed. Di Nisio M. Chichester, UK: John Wiley & Sons, Ltd, 2015.
- Lipe D.N., Foris L.A., King K.C. Septic Thrombophlebitis // Septic Thrombophlebitis. Treasure Island (FL): StatPearls Publishing, 2020.
- Chirinos J.A., Garcia J., Alcaide M.L., Toledo G., Baracco G.J., Lichtstein D.M. Septic thrombophlebitis: diagnosis and management. // Am J Cardiovasc Drugs. 2006. Vol. 6, № 1. P. 9–14.
- Яковлев С., Журавлева М., Проценко Д., Белобородов В., Брико Н., Брусина Е., Гусаров В., Елисеева Е., Замятин М., Зырянов С. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи // Cons. Medicum. 2017. Vol. 19, № 7–1. P. 15–51.
- Mezon B.J., Voitk A.J. Septic superficial thrombophlebitis: a major threat from a minor lesion. // Can Med Assoc J. 1976. Vol. 114, № 12. P. 1128–1132.
- Andes D.R., Urban A.W., Acher C.W., Maki D.G. Septic thrombosis of the basilic, axillary, and subclavian veins caused by a peripherally inserted central venous catheter. // Am J Med. 1998. Vol. 105, № 5. P. 446–450.
- Mailhe M., Aubry C., Brouqui P., Michelet P., Raoult D., Parola P., Lagier J.C. Complications of peripheral venous catheters: The need to propose an alternative route of administration // Int J Antimicrob Agents . Elsevier B.V., 2020. Vol. 55, № 3.
- Heit, Silverstein, Mohr, Petterson, O’Fallon, Melton. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study // Arch Intern Med. Arch Intern Med, 2000. Vol. 160, № 6. P. 809–815.
- Bauersachs, Gerlach, Heinken, Hoffmann, Langer, Noppeney, Pittrow, Klotsche, Rabe. Management and Outcomes of Patients with Isolated Superficial Vein Thrombosis under Real Life Conditions (INSIGHTS-SVT) // Eur J Vasc Endovasc Surg . Eur J Vasc Endovasc Surg, 2021.
- Bates S.M., Rajasekhar A., Middeldorp S., McLintock C., Rodger M.A., James A.H., Vazquez S.R., Greer I.A., Riva J.J., Bhatt M., Schwab N., Barrett D., LaHaye A., Rochwerg B. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy // Blood Adv. 2018. Vol. 2, № 22. P. 3317–3359.
- Bates S.M., Middeldorp S., Rodger M., James A.H., Greer I. Guidance for the treatment and prevention of obstetric-associated venous thromboembolism. // J Thromb Thrombolysis. 2016. Vol. 41, № 1. P. 92–128.
- Thromboembolic Disease in Pregnancy and the Puerperium: Acute Management. RCOG Green-top Guideline No. 37b [Electronic resource] // 2015. URL: https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37b/ (accessed: 21.07.2021).
- Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk. RCOG Green-top Guideline No. 37a [Electronic resource] // 2015. URL: https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37a/ (accessed: 24.07.2021).
- Сухих Г.Т., et al. Профилактика венозных тромбоэмболических осложнений в акушерстве и гинекологии. Клинические рекомендации (протокол) // Акушерство и гинекология. 2014. Vol. 10. P. 1–18.
- Bates S.M., Greer I. a, Middeldorp S., Veenstra D.L., Prabulos A.-M., Vandvik P.O. VTE, Thrombophilia, Antithrombotic Therapy, and Pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. // Chest. 2012. Vol. 141, № 2 Suppl. P. e691S--736S.
- Aaro, Johnson, Juergens. Acute superficial venous thrombophlebitis associated with pregnancy // Am J Obs. Gynecol. Am J Obstet Gynecol, 1967. Vol. 97, № 4. P. 514–518.
- Heit J.A., Kobbervig C.E., James A.H., Petterson T.M., Bailey K.R., Melton L.J. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. // Ann Intern Med. 2005. Vol. 143, № 10. P. 697–706.
- Jacobsen A.F., Skjeldestad F.E., Sandset P.M. Incidence and risk patterns of venous thromboembolism in pregnancy and puerperium--a register-based case-control study. // Am J Obs. Gynecol. United States, 2008. Vol. 198, № 2. P. 233.e1-7.
- Lepercq J., Conard J., Borel-Derlon A., Darmon J.Y., Boudignat O., Francoual C., Priollet P., Cohen C., Yvelin N., Schved J.F., Tournaire M., Borg J.Y. Venous thromboembolism during pregnancy: a retrospective study of enoxaparin safety in 624 pregnancies. // BJOG. England, 2001. Vol. 108, № 11. P. 1134–1140.
- Pettilä V., Leinonen P., Markkola A., Hiilesmaa V., Kaaja R. Postpartum bone mineral density in women treated for thromboprophylaxis with unfractionated heparin or LMW heparin. // Thromb. Haemost. Germany, 2002. Vol. 87, № 2. P. 182–186.
- Carlin A.J., Farquharson R.G., Quenby S.M., Topping J., Fraser W.D. Prospective observational study of bone mineral density during pregnancy: low molecular weight heparin versus control. // Hum. Reprod. England, 2004. Vol. 19, № 5. P. 1211–1214.
- Rodger M.A., Kahn S.R., Cranney A., Hodsman A., Kovacs M.J., Clement A.M., Lazo-Langner A., Hague W.M. Long-term dalteparin in pregnancy not associated with a decrease in bone mineral density: substudy of a randomized controlled trial. // J Thromb Haemost. England, 2007. Vol. 5, № 8. P. 1600–1606.
- Byrd L.M., Shiach C.R., Hay C.R.M., Johnston T.A. Osteopenic fractures in pregnancy: is low molecular weight heparin (LMWH) implicated? // J Obs. Gynaecol. England, 2008. Vol. 28, № 5. P. 539–542.
- Le Templier G., Rodger M.A. Heparin-induced osteoporosis and pregnancy. // Curr. Opin. Pulm. Med. United States, 2008. Vol. 14, № 5. P. 403–407.
- Pomp E.R., Lenselink A.M., Rosendaal F.R., Doggen C.J.M. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. // J. Thromb. Haemost. England, 2008. Vol. 6, № 4. P. 632–637.
- Roach R.E.J., Lijfering W.M., Van Hylckama Vlieg A., Helmerhorst F.M., Rosendaal F.R., Cannegieter S.C. The risk of venous thrombosis in individuals with a history of superficial vein thrombosis and acquired venous thrombotic risk factors // Blood. 2013. Vol. 122, № 26. P. 4264–4269.
- Romualdi E., Dentali F., Rancan E., Squizzato A., Steidl L., Middeldorp S., Ageno W. Anticoagulant therapy for venous thromboembolism during pregnancy: a systematic review and a meta-analysis of the literature. // J. Thromb. Haemost. England, 2013. Vol. 11, № 2. P. 270–281.
- Linnemann B., Scholz U., Rott H., Halimeh S., Zotz R., Gerhardt A., Toth B., Bauersachs R. Treatment of pregnancy-associated venous thromboembolism - position paper from the Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH) // Vasa. 2016. Vol. 45, № 2. P. 103–118.
- Sanson B.J., Lensing A.W., Prins M.H., Ginsberg J.S., Barkagan Z.S., Lavenne-Pardonge E., Brenner B., Dulitzky M., Nielsen J.D., Boda Z., Turi S., Mac Gillavry M.R., Hamulyák K., Theunissen I.M., Hunt B.J., Büller H.R. Safety of low-molecular-weight heparin in pregnancy: a systematic review. // Thromb Haemost. Germany, 1999. Vol. 81, № 5. P. 668–672.
- Warkentin T.E., Levine M.N., Hirsh J., Horsewood P., Roberts R.S., Gent M., Kelton J.G. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. // N Engl J Med. United States, 1995. Vol. 332, № 20. P. 1330–1335.
- Weitz J.I. Low-molecular-weight heparins. // N Engl J Med. United States, 1997. Vol. 337, № 10. P. 688–698.
- Greer I.A., Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. // Blood. United States, 2005. Vol. 106, № 2. P. 401–407.
- ACOG Practice Bulletin No. 196: Thromboembolism in Pregnancy // Obs. Gynecol. Obstet Gynecol, 2018. Vol. 132, № 1. P. e1–e17.
- Romualdi E., Dentali F., Rancan E., Squizzato A., Steidl L., Middeldorp S., Ageno W. Anticoagulant therapy for venous thromboembolism during pregnancy: a systematic review and a meta-analysis of the literature. // J Thromb Haemost. England, 2013. Vol. 11, № 2. P. 270–281.
- Jacobson B., Rambiritch V., Paek D., Sayre T., Naidoo P., Shan J., Leisegang R. Safety and Efficacy of Enoxaparin in Pregnancy: A Systematic Review and Meta-Analysis. // Adv Ther. 2020. Vol. 37, № 1. P. 27–40.
- Anticoagulation in Pregnancy and Lactation // Precis. Anticoagulation Med. / ed. Goubran H., Ragab G., Hassouna S. Springer Nature, 2020. P. 147–157.
- Tang A.-W., Greer I. A systematic review on the use of new anticoagulants in pregnancy. // Obs. Med. 2013. Vol. 6, № 2. P. 64–71.
- Bapat P., Pinto L.S.R., Lubetsky A., Berger H., Koren G. Rivaroxaban transfer across the dually perfused isolated human placental cotyledon. // Am J Obs. Gynecol. United States, 2015. Vol. 213, № 5. P. 710.e1-6.
- Nakhai-Pour H.R., Broy P., Sheehy O., Bérard A. Use of nonaspirin nonsteroidal anti-inflammatory drugs during pregnancy and the risk of spontaneous abortion. // CMAJ. 2011. Vol. 183, № 15. P. 1713–1720.
- Nielsen G.L., Sørensen H.T., Larsen H., Pedersen L. Risk of adverse birth outcome and miscarriage in pregnant users of non-steroidal anti-inflammatory drugs: population based observational study and case-control study. // BMJ. 2001. Vol. 322, № 7281. P. 266–270.
- Stergiakouli E., Thapar A., Davey Smith G. Association of Acetaminophen Use During Pregnancy With Behavioral Problems in Childhood: Evidence Against Confounding. // JAMA Pediatr. 2016. Vol. 170, № 10. P. 964–970.
- Nielsen G.L., Skriver M.V., Pedersen L., Sørensen H.T. Danish group reanalyses miscarriage in NSAID users. // BMJ. 2004. Vol. 328, № 7431. P. 109.
- Li D.-K., Liu L., Odouli R. Exposure to non-steroidal anti-inflammatory drugs during pregnancy and risk of miscarriage: population based cohort study. // BMJ. 2003. Vol. 327, № 7411. P. 368.
- Edwards D.R.V., Aldridge T., Baird D.D., Funk M.J., Savitz D.A., Hartmann K.E. Periconceptional over-the-counter nonsteroidal anti-inflammatory drug exposure and risk for spontaneous abortion. // Obs. Gynecol. 2012. Vol. 120, № 1. P. 113–122.
- MHRA Medicines and Health Regulatory Agency. MHRA Drug Safety Update [Electronic resource] // 2015. 2020. URL: http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUpdate (accessed: 09.10.2020).
- Rigourd V., de Villepin B., Amirouche A., Bruneau A., Seraissol P., Florent A., Urien S., Magny J.-F., Serreau R. Ibuprofen concentrations in human mature milk--first data about pharmacokinetics study in breast milk with AOR-10127 “Antalait” study. // Ther Drug Monit. United States, 2014. Vol. 36, № 5. P. 590–596.
- Stanley A.Y., Durham C.O., Sterrett J.J., Wallace J.B. Safety of Over-the-Counter Medications in Pregnancy. // MCN Am J Matern Child Nurs. United States, 2019. Vol. 44, № 4. P. 196–205.
- New FDA Pregnancy Categories Explained [Electronic resource] // 2015. URL: https://www.drugs.com/pregnancy-categories.html (accessed: 09.10.2020).
- Briggs G., Freeman R. Acetaminophen // Drugs Pregnancy Lact. A Ref. Guid. to Fetal Neonatal Risk. 11th ed. Philadelphia: Wolters Kluwer Health, 2017. P. 66–74.
- Roberge S., Giguère Y., Villa P., Nicolaides K., Vainio M., Forest J.-C., von Dadelszen P., Vaiman D., Tapp S., Bujold E. Early administration of low-dose aspirin for the prevention of severe and mild preeclampsia: a systematic review and meta-analysis. // Am J Perinatol. United States, 2012. Vol. 29, № 7. P. 551–556.
- Poon L.C., Shennan A., Hyett J.A., Kapur A., Hadar E., Divakar H., McAuliffe F., da Silva Costa F., von Dadelszen P., McIntyre H.D., Kihara A.B., Di Renzo G.C., Romero R., D’Alton M., Berghella V., Nicolaides K.H., Hod M. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention. // Int J Gynaecol Obs. 2019. Vol. 145 Suppl, № Suppl 1. P. 1–33.
- US Food and Drug Administration, Title 21--Food and Drugs, chapter «I»--Food and Drug administration, department of health and human services, Subchapter «D»--Drugs for human use, Part 341 -343 [Electronic resource]. 2015. URL: https://www.law.cornell.edu/cfr/text/21/chapter-I/subchapter-D (accessed: 17.10.2020).
- Datta P., Rewers-Felkins K., Kallem R.R., Baker T., Hale T.W. Transfer of Low Dose Aspirin Into Human Milk. // J Hum Lact. United States, 2017. Vol. 33, № 2. P. 296–299.
- World Health Organization, UNICE. Breastfeeding and maternal medication. Recommendations for drugs in the eleventh WHO model list of essential drugs. 2002. 35 p.
- Flessa H.C., Kapstrom A.B., Glueck H.I., Will J.J. Placental transport of heparin. // Am J Obs. Gynecol. United States, 1965. Vol. 93, № 4. P. 570–573.
- Clark N.P., Delate T., Witt D.M., Parker S., McDuffie R. A descriptive evaluation of unfractionated heparin use during pregnancy. // J Thromb Thrombolysis. Netherlands, 2009. Vol. 27, № 3. P. 267–273.
- Ginsberg J.S., Kowalchuk G., Hirsh J., Brill-Edwards P., Burrows R. Heparin therapy during pregnancy. Risks to the fetus and mother. // Arch Intern Med. United States, 1989. Vol. 149, № 10. P. 2233–2236.
- Streiff M.B., et al. NCCN Guidelines Insights: Cancer-Associated Venous Thromboembolic Disease, Version 21.2020. // J Natl Compr Canc Netw. United States, 2020.
- Galanaud J.-P., Blaise S., Sevestre M.-A., Terrisse H., Pernod G., Gaillard C., Genty C., Monreal M., Rabah Y., Kahn S.R., Quéré I., Bosson J.-L. Long-term outcomes of isolated superficial vein thrombosis in patients with active cancer. // Thromb Res. United States, 2018. Vol. 171. P. 179–186.
- Ploton, Pistorius, Raimbeau, Denis Le Seve, Bergère, Ngohou, Goueffic, Artifoni, Durant, Gautier, Connault, Espitia. A STROBE cohort study of 755 deep and superficial upper-extremity vein thrombosis // Med. . Medicine (Baltimore), 2020. Vol. 99, № 6.
- Chen P., Zhu B., Wan G., Qin L. The incidence of asymptomatic thrombosis related to peripherally inserted central catheter in adults: A systematic review and meta‐analysis People’s // Nurs Open. Nurs Open, 2021. P. Online ahead of print.
- Сомонова О.В., Антух Э.А., Долгушин Б.И., Елизарова А.Л., Сельчук В.Ю., Черкасов В.А. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Злокачественные опухоли : Практические рекомендации RUSSCO // #3s2. 2019. Vol. 9. 668–677 p.
- Сушинская Т.В., Стуклов Н.И., Доброхотова Ю.Э. Гемостаз и рак-ассоциированный тромбоз: современная профилактика и лечение // Онкология. Журнал им. П.А. Герцена. 2018. Vol. 7, № 4. P. 64–72.
- Пустовойт А., Гаврилов С.Г., Золотухин И.А. Тактика лечения острого восходящего тромбофлебита // Флебология. 2011. Vol. 5. P. 46–52.
- Wang G., Li Y., Wu C., Guo L., Hao L., Liao H., Xiao X., Liu S., Luo L. The clinical features and related factors of PICC-related upper extremity asymptomatic venous thrombosis in cancer patients: A prospective study. // Medicine (Baltimore). 2020. Vol. 99, № 12. P. e19409.
- Dammacco F., Vacca A., Procaccio P., Ria R., Marech I., Racanelli V. Cancer-related coagulopathy (Trousseau’s syndrome): review of the literature and experience of a single center of internal medicine. // Clin Exp Med. 2013. Vol. 13, № 2. P. 85–97.
- Mate-Kole M.O., Nkrumah K. Thrombophlebitis migrans as a marker of malignancy. // East Afr Med J. 1986. Vol. 63, № 9. P. 610–612.
- Воробьев А.В., Макацария А.Д., Чабров А.М., Савченко А.А. Синдром Труссо: современный взгляд на проблему // Журнал акушерства и женских болезней. 2015. Vol. 64, № 4. P. 85–94.
- Fazeli B., Modaghegh H., Ravrai H., Kazemzadeh G. Thrombophlebitis migrans as a footprint of Buerger’s disease: a prospective-descriptive study in north-east of Iran. // Clin Rheumatol. 2008. Vol. 27, № 1. P. 55–57.
- Зербино Д., Зимба Е., Багрий Н. Облитерирующий тромбангиит (болезнь Бюргера): современное состояние проблемы // Ангиология и сосудистая хирургия. 2016. Vol. 22, № 4. P. 390–395.
- Mondor H. Tronculite sous-cutanée subaiguë de la paroi thoraccique antero-laterale // Mem Acad Chir. 1939. Vol. 65. P. 1271–1278.
- Cervellin G., Creta M., Riva M., Di Comite V., Buttarelli L., Lippi G. Abdominal Mondor’s disease presenting as acute abdominal pain. // Acta Biomed. 2013. Vol. 84, № 2. P. 155–158.
- Hou M.F., Huang C.J., Huang Y.S., Hsieh J.S., Chan H.M., Wang J.Y., Chuang C.H., Chen F.M., Huang T.J. Mondor’s disease in the breast. // Kaohsiung J Med Sci. 1999. Vol. 15, № 11. P. 632–639.
- Pasta V., D’Orazi V., Sottile D., Del Vecchio L., Panunzi A., Urciuoli P. Breast Mondor’s disease: Diagnosis and management of six new cases of this underestimated pathology. // Phlebology. 2015. Vol. 30, № 8. P. 564–568.
- Pugh C.M., DeWitty R.L. Mondor’s disease. // J Natl Med Assoc. 1996. Vol. 88, № 6. P. 359–363.
- Amano M., Shimizu T. Mondor’s Disease: A Review of the Literature // Intern Med. Intern Med, 2018. Vol. 57, № 18. P. 2607–2612.
- Scovell S.D., Ergul E.A., Conrad M.F. Medical management of acute superficial vein thrombosis of the saphenous vein // J Vasc Surg Venous Lymphat Disord. 2017.
- Ruben, Wouter, Jorn, Reinold, Karina, Frederik, Horst V. Der, Iwan. Intermediate Dose Low-Molecular-Weight Heparin for Thrombosis Prophylaxis: Systematic Review with Meta-Analysis and Trial Sequential Analysis // Semin Thromb Hemost. 2019. Vol. 45, № 8. P. 810–824.
- Belcaro G., Nicolaides A.N., Errichi B.M., Cesarone M.R., Sanctis M.T. De, Incandela L., Venniker R., Belcaro G. Superficial Thrombophlebitis of the Legs: A Randomized, Controlled, Follow-up Study // Angiology. 1999. Vol. 50, № 7. P. 523–529.
- Simes J., Becattini C., Agnelli G., Eikelboom J.W., Kirby A.C., Mister R., Prandoni P., Brighton T.A., INSPIRE Study Investigators (International Collaboration of Aspirin Trials for Recurrent Venous Thromboembolism). Aspirin for the prevention of recurrent venous thromboembolism: the INSPIRE collaboration. // Circulation. 2014. Vol. 130, № 13. P. 1062–1071.
- Weitz J.I., et al. Rivaroxaban or Aspirin for Extended Treatment of Venous Thromboembolism // N Engl J Med. 2017. Vol. 376, № 13. P. 1211–1222.
- Messa G., La Placa G., Puccetti L., Di Perri T. Effectiveness and tolerability of heparan sulfate in the treatment of superficial thrombophlebitis. Controlled clinical study vs sulodexide // Minerva Cardioangiol. 1997. Vol. 45, № 4. P. 147–153.
- Andreozzi G.M., Bignamini A.A., Davì G., Palareti G., Matuška J., Holý M., Pawlaczyk-Gabriel K., Džupina A., Sokurenko G.Y., Didenko Y.P., Andrei L.D., Lessiani G., Visonà A. Sulodexide for the prevention of recurrent venous thromboembolism: The Sulodexide in Secondary Prevention of Recurrent Deep Vein Thrombosis (SURVET) study: A multicenter, randomized, double-blind, placebo-controlled trial // Circulation. 2015. Vol. 132, № 20. P. 1891–1897.
- Paraskevas K.I., Nicolaides A.N., Mikhailidis D.P. Statins and venous thromboembolism: the jury is still out. // Angiology. 2013. Vol. 64, № 7. P. 489–491.
- Enas E.A., Kuruvila A., Khanna P., Pitchumoni C.S., Mohan V. Benefits vs risks of statin therapy for primary prevention of cardiovascular disease in Asian Indians - a population with the highest risk of premature coronary artery disease & diabetes. // Indian J Med Res. 2013. Vol. 138, № 4. P. 461–491.
- Squizzato A., Galli M., Romualdi E., Dentali F., Kamphuisen P.W., Guasti L., Venco A., Ageno W. Statins, fibrates, and venous thromboembolism: a meta-analysis. // Eur Hear. J. 2010. Vol. 31, № 10. P. 1248–1256.
- Kunutsor S.K., Seidu S., Khunti K. Statins and secondary prevention of venous thromboembolism: pooled analysis of published observational cohort studies. // Eur Hear. J. 2017. Vol. 38, № 20. P. 1608–1612.
- Sheikh P., Lohsiriwat V., Shelygin Y. Micronized Purified Flavonoid Fraction in Hemorrhoid Disease: A Systematic Review and Meta-Analysis. // Adv Ther. 2020. Vol. 37, № 6. P. 2792–2812.
- Nocker W., Diebschlag W., Lehmacher W. The efficacy of a diclofenac gel compared with placebo and heparin gel in the local treatment of superficial thrombophlebitis // Z Allg Med. 1991. Vol. 67. P. 2214–2222.
- Winter W., Klotten K., Arnold S., Babiak D., Stoinder B. Local therapy of thrombophlebitis-superficialis-an interindividual comparison of voltaren emulgel versus a heparin-containing gel // Z Rheumatol. 1986. Vol. 45, № 4. P. 180–181.
- Holzgreve A., Kleine W., Stegmann W. Local treatment of superficial thrombophlebitis with nonsteroidal antiinflammatory agents. // ZFA. 1989. Vol. 65, № 27. P. 663–667.
- Кургинян Х.М., Раскин В.В. Эндоваскулярное лечение острого тромбофлебита вен нижних конечностей у пациентов с варикозной болезнью // Хирургия. Журнал им. Н.И. Пирогова. 2019. Vol. 10. P. 50–54.
- Шабунин А., Гаврилов С., Пустовойт С., Бычкова Т., Каралкин А., Золотухин И. Сравнение эффективности хирургической и консервативной тактики при остром восходящем варикотромбофлебите большой подкожной вены бедра // Флебология. 2013. Vol. 7, № 2. P. 10–14.
- Швальб П., Качинский А., Нарижный М. Флебоцентез — миниинвазивный способ лечения острого тромбофлебита подкожных вен // Флебология. 2009. Vol. 3, № 3. P. 23–25.
- Enzler M.A., Russell D., Schimmelpfennig J. Thermal ablation in the management of superficial thrombophlebitis. // Eur J Vasc Endovasc Surg. England, 2012. Vol. 43, № 6. P. 726–728.
- Gradman W.S. Endovenous saphenous vein ablation in patients with acute isolated superficial-vein thrombosis // Phlebology. 2015. Vol. 30, № 3. P. 204–209.
- Figueiredo, Stansby, Bhattacharya. Primary prevention of venous thromboembolism // Phlebology. Phlebology, 2012. Vol. 27 Suppl 2, № SUPPL.2. P. 23–32.
- Chang S.L., Huang Y.L., Lee M.C., Hu S., Hsiao Y.C., Chang S.W., Chang C.J., Chen P.C. Association of Varicose Veins With Incident Venous Thromboembolism and Peripheral Artery Disease // JAMA. JAMA, 2018. Vol. 319, № 8. P. 807–817.
- Clarke M., Hopewell S., Juszczak E., Eisinga A., Kjeldstrøm M. Compression stockings for preventing deep vein thrombosis in airline passengers. Cochrane Database of Systematic Reviews. 2016. № 9. P. 50.
- Galanaud J.-P., Sevestre M.-A., Pernod G., Kahn S.R., Genty C., Terrisse H., Brisot D., Gillet J.-L., Quéré I., Bosson J.-L. Long-term risk of venous thromboembolism recurrence after isolated superficial vein thrombosis. // J Thromb Haemost. England, 2017. Vol. 15, № 6. P. 1123–1131.
- Jiang Q.J., Bai J., Jin J., Shi J., Qu L. Sulodexide for secondary prevention of recurrent venous thromboembolism: A systematic review and meta-analysis // Front Pharmacol. 2018. Vol. 9. P. 876.
- Brighton T.A., Eikelboom J.W., Mann K., Mister R., Gallus A., Ockelford P., Gibbs H., Hague W., Xavier D., Diaz R., Kirby A., Simes J. Low-dose aspirin for preventing recurrent venous thromboembolism. // N Engl J Med. 2012. Vol. 367, № 21. P. 1979–1987.
- Wang K.L., van Es N., Cameron C., Castellucci L.A., Büller H.R., Carrier M. Extended treatment of venous thromboembolism: a systematic review and network meta-analysis // Heart. Heart, 2019. Vol. 105, № 7. P. 545–552.
- Vasanthamohan L., Boonyawat K., Chai-Adisaksopha C., Crowther M. Reduced-dose direct oral anticoagulants in the extended treatment of venous thromboembolism: a systematic review and meta-analysis // J Thromb Haemost. J Thromb Haemost, 2018. Vol. 16, № 7. P. 1288–1295.
- Camporese G., Bernardi E., Noventa F. Update on the clinical use of the low-molecular-weight heparin, parnaparin // Vasc Heal. Risk Manag. 2009. Vol. 5. P. 819–831.
- Mitić G., Kovac M., Povazan L., Djordjević V., Ilić V., Salatić I., Lazić R., Antonijević N., Novakov-Mikić A. Efficacy and safety of nadroparin and unfractionated heparin for the treatment of venous thromboembolism during pregnancy and puerperium // Srp Arh Celok Lek. Srp Arh Celok Lek, 2010. Vol. 138 Suppl. P. 18–22.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Бицадзе В.О., д.м.н., профессор, профессор РАН, член Российского общества акушеров-гинекологов, член Национальной ассоциации специалистов по тромбозам, клинической гемостазиологии и гемореологии;
- Бредихин Р.А., д.м.н., член Ассоциации флебологов России (АФР), исполнительный секретарь общества флебологов Республики Татарстан, член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS);
- Булатов В.Л., к.м.н., член Ассоциации флебологов России (АФР);
- Головина В.И., член Ассоциации флебологов России (АФР), Engagement working group International Union of Phlebology;
- Дженина О.В., член Ассоциации флебологов России (АФР);
- Золотухин И.А., д.м.н., профессор, профессор РАН, исполнительный секретарь Ассоциации флебологов России (АФР);
- Илюхин Е.А., к.м.н., вице-президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ);
- Калинин Р.Е., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), член правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), член European Society for Vascular Surgery (ESVS).
- Каторкин С.Е., д.м.н., доцент, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ).
- Кириенко А.И., д.м.н., академик РАМН, академик РАН, почетный президент Ассоциации флебологов России (АФР), вице-президент Российского общества хирургов (РОХ), член президиума Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член совета European Society for Vascular Surgery (ESVS), лауреат Государственной премии РФ, премии Правительства РФ, премий имени академика А.Н. Бакулева и имени академика Е.Н. Мешалкина;
- Крылов А.Ю., д.м.н., профессор, член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества ангиологов и сосудистых хирургов (РОАиСХ);
- Лобастов К.В., к.м.н., член Ассоциации флебологов России (АФР), European Venous Forum (EVF), International Union of Angiology (IUA);
- Макацария А.Д., д.м.н., профессор, заслуженный врач РФ, член-корреспондент РАМН, член-корреспондент РАН, вице-президент Российского общества акушеров-гинекологов, доктор медицинских наук, академик РАН, член Национальной ассоциации специалистов по тромбозам, клинической гемостазиологии и гемореологии, лауреат премии имени В. Ф. Снегирева;
- Мжаванадзе Н.Д., к.м.н., член Ассоциации флебологов России (АФР), Российского общества ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS).
- Порембская О.Я., к.м.н., член Ассоциации флебологов России (АФР), European Venous Forum (EVF);
- Прядко С.И., к.м.н., член исполнительного совета Ассоциации флебологов России (АФР), зам. председателя секции «Флебология и лимфология» Ассоциации сердечно-сосудистых хирургов России (АССХ), European Society for Vascular Surgery (ESVS), European Society of CardioVascular Surgery (ESCVS);
- Селиверстов Е.И., к.м.н., член Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ);
- Сонькин И.Н., член Ассоциации флебологов России (АФР), Ассоциации сердечно-сосудистых хирургов России (АССХ);
- Сорока В.В., д.м.н., профессор, заслуженный врач РФ;
- Стойко Ю.М., д.м.н., профессор, заслуженный врач РФ, заслуженный деятель науки РФ, лауреат премии Правительства РФ, почетный президент Ассоциации флебологов России (АФР), член правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), почетный член European Venous Forum (EVF);
- Сучков И.А., д.м.н., профессор, президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ); член Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Ассоциации сердечно-сосудистых хирургов России (АССХ), член European Society for Vascular Surgery (ESVS).
- Счастливцев И.В., к.м.н., доцент, член Ассоциации флебологов России (АФР), European Venous Forum (EVF), Российского общества хирургов (РОХ), Ассоциации специалистов по тромбозам, клинической гемостазиологии и гемореологии (НАТГ);
- Черкашин М.А., член Ассоциации флебологов России (АФР), European Society of Medical Oncology, European Society of Radiology.
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки или другого конфликта интересов при составлении данных рекомендаций.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория разработанных клинических рекомендаций:
- Врач - сердечно-сосудистый хирург;
- Врач – хирург;
- Врач ультразвуковой диагностики;
- Студенты медицинских ВУЗов, ординаторы, аспиранты.
Рекомендации основаны на совокупном анализе доказательств, представленных в мировой литературе и полученных в результате клинического применения современных принципов и методов диагностики и лечения тромбофлебита вен конечностей. Основные положения Рекомендаций ранжируются в соответствии с Приказом Министерства здравоохранения РФ от 28 февраля 2019 г. № 103н "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации”. Рекомендации подготовлены в соответствии с Методическими рекомендациями по проведению оценки научной обоснованности включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Министерства здравоохранения Российской Федерации, 2019 г.
- Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств):
- Систематические обзоры исследований с контролем референтным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
- Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
- Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
- Несравнительные исследования, описание клинического случая
- Имеется лишь обоснование механизма действия или мнение экспертов
- Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации:
- Систематический обзор рандомизированных клинических исследований с применением мета-анализа
- Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
- Нерандомизированные сравнительные исследования, в том числе когортные исследования
- Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль»
- Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
- Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
- Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
- Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
- Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Приложение А 3.1. Факторы риска геморрагических осложнений во время беременности, родов или в послеродовом периоде
Факторы риска геморрагических осложнений во время беременности, родов или в послеродовом периоде приведены в соответствии с рекомендациями RCOG/РОАГ) [89,113,114].
- Дородовые или послеродовые кровотечения
- Высокий риск большого кровотечения (например, при предлежании плаценты)
- Гемофилия или другие диагностированные нарушения свертываемости крови (например, болезнь фон Виллебранда или приобретенная коагулопатия)
- Тромбоцитопения (количество тромбоцитов менее 75 x 109 )
- Острый инсульт в предшествующие 4 недели (ишемический или геморрагический)
- Почечная недостаточность (скорость клубочковой фильтрации менее 30 мл/мин/1.73 м2)
- Печеночная недостаточность (протромбиновое время выше нормы или имеющееся варикозное расширение вен)
- Неконтролируемая артериальная гипертензия (систолическое артериальное давление выше 200 мм.рт.ст. или диастолическое артериальное давление выше 120 мм.рт.ст.).
Приложение А 3.2. Профилактические дозы НМГ (АХТ: B01AB Группа гепарина) в зависимости от массы тела до беременности
На основе рекомендаций RCOG/РОАГ [89,110,113–115,206]
|
|
АТХ: B01AB05 Эноксапарин натрия** |
АТХ: B01AB04 Далтепарин натрия |
АТХ: B01AB06 Надропарин кальция |
АТХ: B01AB07 Парнапарин натрия** |
|
< 50 кг |
20мг /сут |
2500 МЕ /сут |
2850 МЕ /сут |
3200 МЕ х 1 р/сут |
|
50 – 90 кг |
40мг /сут |
5000 МЕ /сут |
5700 МЕ /сут |
|
|
91 – 130 кг |
60мг /сут |
7500 МЕ /сут |
7600 МЕ /сут |
|
|
131 – 170 кг |
80мг /сут |
10 000 МЕ /сут |
9500 МЕ /сут |
|
|
> 170 кг |
0,6мг/кг/сут |
75 МЕ/кг/сут |
86 МЕ/кг/сут |
4250 МЕ х 1 р/сут |
Приложение А 3.3. Лечебные дозы НМГ (АХТ: B01AB Группа гепарина) в зависимости от массы тела до беременности
На основе рекомендаций RCOG/РОАГ [89,113,114,206,207].
|
Масса тела до беременности |
||||
|
|
АТХ: B01AB05 Эноксапарин натрия** |
АТХ: B01AB04 Далтепарин натрия |
АТХ: B01AB06 Надропарин кальция |
АТХ: B01AB07 Парнапарин натрия** |
|
< 50 кг |
40мг х 2р/сут |
5000 МЕ х 2р/сут |
3800 МЕ х 2 р/д |
6400 МЕ х 1 р/сут∇ |
|
50 – 69 кг |
60мг х 2р/сут |
6000 МЕ х 2р/сут |
50+ кг: 4750 МЕх 2 р/д 60+ кг: 5700 МЕ х 2 р/д |
|
|
70 – 89 кг |
80мг х 2р/сут |
8000 МЕ х 2р/сут |
70+ кг: 6650 МЕ х 2 р/д 80+ кг: 7600 МЕ х 2 р/д |
|
|
90 - 109 |
100мг х 2р/сут |
10000 МЕ х 2р/сут |
90+ кг: 8550 МЕ х 2 р/д 100+кг: 9500 МЕ х 2 р/д |
|
|
110 – 125 кг |
120мг 2р/сут |
12000 МЕ х 2р/сут |
консилиум |
|
|
> 125 кг |
консилиум |
консилиум |
консилиум |
консилиум |
∇ Лечебная доза парнапарина натрия** для лечения ТФПВ на фоне беременности указана в соответствии с инструкцией. Дозировка парнапарина натрия** для лечения ТФПВ вне беременности, изученная в исследовании STEFLUX, приведена в соответствующем разделе.
Приложение А 3.4. Тактика лечения ТФПВ во время беременности
|
ТФПВ во время беременности |
|||||
|
Период ТФПВ |
Степень риска перехода тромба на глубокие вены |
«Базовая» терапия ТФПВ |
Наличие факторов риска ВТЭО |
АКТ в оставшийся срок беременности |
АКТ после родов∗ |
|
Острый и стихающий |
Высокий риск |
до 45 дней (до перехода в стихший период), лечебная доза |
Вне зависимости от факторов риска |
Продлить АКТ до конца беременности, профилактическая доза |
6 нед |
|
Умеренный риск |
до 45 дней (до перехода в стихший период), 50-75% лечебной дозы |
||||
|
Низкий риск |
до 45 дней (до перехода в стихший период), 50-75% лечебной дозы |
≥ 1 высок, |
|||
|
2 ср/низк, ТФПВ развился с 20 недели |
Продлить АКТ до конца беременности, профилактическая доза |
не менее 10 дней |
|||
|
2 ср/низк, ТФПВ развился до 20 недели |
Завершить и возобновить АКТ с 28 недели, профилактическая доза |
||||
|
1 ср/низк, Нет факторов риска |
АКТ не требуется |
||||
|
Стихший тромбофлебит любой локализации и протяженности |
Не проводить |
≥ 1 высок |
Начать и провести АКТ до конца беременности, профилактическая доза |
6 нед |
|
|
2 ср/низк |
Начать и провести АКТ с 28 недели, профилактическая доза |
не менее 10 дней |
|||
|
1 ср/низк, Нет факторов риска |
АКТ не требуется |
||||
∗ в послеродовом периоде рекомендуется продолжить антикоагуляцию в той же дозе, которая была использована перед родами.
Приложение А 3.5. Тактика лечения ТФПВ в послеродовом периоде
|
ТФПВ в течение 6 недель послеродового периода |
|||
|
Период ТФПВ |
Степень риска перехода тромба на глубокие вены |
Наличие факторов риска ВТЭО |
Терапия |
|
Острый и стихающий |
Высокий риск |
Вне зависимости от наличия |
45 дней, лечебная доза |
|
Умеренный риск |
45 дней, 50-75% лечебной дозы |
||
|
Низкий риск |
45 дней, 50-75% лечебной дозы |
||
|
Стихший ТФПВ, развившийся во время беременности |
≥1 высок, |
до срока 6 недель от родов, профилактическая доза |
|
|
≤ 2 ср/низк |
до срока 10 дней от родов, профилактическая доза, или наблюдение |
||
Приложение А 3.6. Промежуточные дозы низкомолекулярных гепаринов (НМГ, АТХ: B01AB Группа гепарина)
(по данным систематического обзора с метаанализом Ruben J. с соавт.) [179]
|
АТХ |
Промежуточная доза |
|
B01AB12 Бемипарин натрия |
≥ 3500 МЕ |
|
B01AB04 Далтепарин натрия |
≥ 5000 МЕ |
|
B01AB06 Надропарин кальция |
≥ 5700 МЕ |
|
B01AB07 Парнапарин натрия** |
≥ 4250 МЕ |
|
B01AB05 Эноксапарин натрия** |
≥ 40 мг |
МЕ – международные единицы, мг – миллиграммы.
Приложение Б. Алгоритмы действий врача
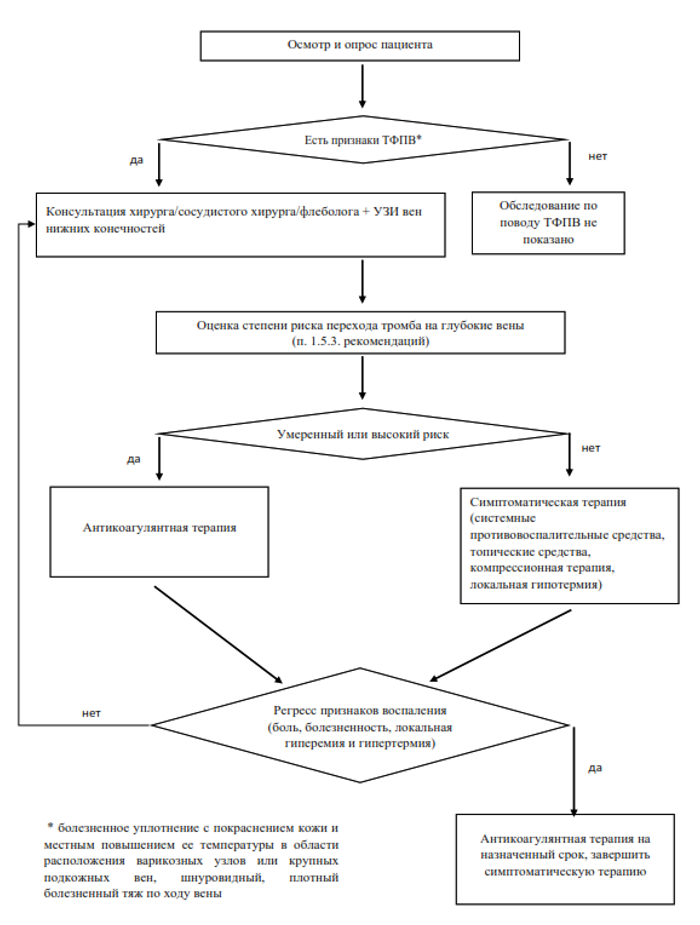
Приложение В. Информация для пациентов
- Основными признаками острого тромбофлебита поверхностных вен является болезненное уплотнение с покраснением кожи и местным повышением ее температуры в области расположения варикозных узлов или крупных подкожных вен, возможно наличие шнуровидного плотного болезненного тяжа.
- Тромбофлебит поверхностных вен ассоциирован с риском распространения тромба на глубокие вены и развитием тромбоэмболических осложнений.
- Основным методом диагностики является ультразвуковое исследование вен.
- Показаниями для госпитализации являются высокий риск распространения тромба на глубокие вены в острую стадию тромбофлебита или развитие гнойного тромбофлебита
- При тромбофлебите притоков магистральных вен могут быть назначены нестероидные противовоспалительные препараты местно или системно (в таблетках, капсулах), компрессионная терапия (компрессионный трикотаж 1 - 2 степени компрессии), иные местные и системные средства (гепарины, веноактивные препараты), локальная гипотермия.
- В некоторых ситуациях при лечении тромбофлебита поверхностных вен для предотвращения распространения тромба на глубокие вены и развития тромбоэмболических осложнений могут быть назначены антикоагулянты (АХТ: антитромботические средства).
- При распространении тромба на магистральные поверхностные вены лечение проводится по правилам лечения тромбоза глубоких вен
- Хирургические методы лечения при остром тромбофлебите выбирают при невозможности проведения полноценной антикоагулянтной терапии и высоком риске распространения тромба на глубокие вены и развития тромбоэмболических осложнений.
Приложения Г1, Г2. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.
Приложение Г1. Факторы риска геморрагических осложнений при антикоагулянтной терапии и предполагаемый риск большого кровотечения в категориях низкого, среднего и высокого риска
Название на русском языке: Факторы риска геморрагических осложнений при антикоагулянтной терапии и предполагаемый риск «большого» кровотечения в категориях низкого, среднего и высокого риска.
Оригинальное название: Risk Factors for Bleeding with Anticoagulant Therapy and Estimated Risk of Major Bleeding in Low-, Moderate-, and High-Risk categories.
Источник (официальный сайт разработчиков, публикация с
валидацией): https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltext
Рекомендации ACCP (the American College of Chest Physicians) 9, 2016 [58].
Тип: шкала оценки
Назначение: оценка риска «большого» кровотечения при проведении антикоагулянтной терапии
Оценочный инструмент, содержание:
Факторы риска кровотечения при антикоагулянтной терапии
- Возраст >65 лет
- Возраст >75 лет
- Кровотечения в анамнезе
- Рак
- Метастазы
- Почечная недостаточность
- Печеночная недостаточность
- Тромбоцитопения
- Инсульт в анамнезе
- Диабет
- Анемия
- Антиагрегантная терапия
- Плохой антикоагулянтный контроль
- Коморбидность
- Недавняя операция
- Частые падения
- Злоупотребление алкоголем
- Применение НПВП
Предполагаемый риск большого кровотечения в категориях низкого, среднего и высокого риска
|
Абсолютный риск большого кровотечения |
|||
|
Низкий риск (0 факторов риска) |
Средний риск (1 фактор риска) |
Высокий риск (2 и более факторов риска |
|
|
Антикоагулянтная терапия 0-3 мес. |
|||
|
Базальный риск (%) |
0,6 |
1,2 |
4,8 |
|
Повышение риска (%) |
1 |
2 |
8 |
|
Общий риск (%) |
1,6 |
3,2 |
12,8 |
|
Антикоагулянтная терапия >3 месяцев |
|||
|
Базальный риск (%) |
0,3 |
0,6 |
≥2,5 |
|
Повышение риска (%) |
0,5 |
1 |
≥4,0 |
|
Общий риск (%) |
0,8 |
1,6 |
≥6,5 |
Ключ (интерпретация): отсутствие факторов риска кровотечения – категория низкого риска развития «большого» кровотечения, 1 фактор риска – категория среднего риска, 2 и более факторов риска – категория высокого риска.
Приложение Г2. Градация значимости факторов риска рецидива ВТЭО во время беременности и в послеродовом периоде
Название на русском языке: Градация значимости факторов риска рецидива ВТЭО во время беременности и в послеродовом периоде.
Оригинальное название: нет
Источник (официальный сайт разработчиков, публикация с
валидацией): https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37a/
Тип: шкала оценки
Назначение: оценка значимости факторов риска ВТЭО во время беременности и в послеродовом периоде в категориях низкого, среднего и высокого риска.
Оценочный инструмент, содержание:
|
Фактор |
Значимость фактора риска |
|
Личный анамнез ВТЭО в виде ТГВ или ТЭЛА |
Высокий риск* |
|
Наследственные тромбофилии: гомо- и гетерозиготные полиморфизмы ф.V и/или ф.II |
|
|
Дефицит протеина С, протеина S, АФС |
|
|
Гипергомоцистеинемия тяжелой степени (100 мкмоль/л и выше), фактор учитывается до момента нормализации уровня гомоцистеина |
|
|
Активное злокачественное новообразование |
|
|
Перенесенный в текущую беременность ТФПВ |
Средний риск |
|
Тяжелое заболевание, например: обострение воспалительного заболевания кишечника, системная красная волчанка, серповидно-клеточная анемия с гемолизом, хроническая сердечная недостаточность, полиартропатия, нефротический синдром, сахарный диабет I типа с нефропатией |
|
|
Гипергомоцистеинемия легкой (15-29 мкмоль/л) и средней (30-99 мкмоль/л) степени, фактор учитывается до момента нормализации уровня гомоцистеина |
|
|
Любая хирургическая процедура во время беременности или послеродовом периоде |
|
|
Синдром гиперстимуляции яичников (только первый триместр) |
|
|
ИМТ >40 |
|
|
Кесарево сечение в родах |
|
|
Гиперемезис (тяжелая тошнота и рвота с дегидратацией) |
|
|
Семейный анамнез ВТЭО (особенно неспровоцированный или эстроген-индуцированный ВТЭО у родственников 1-й линии родства |
Низкий риск |
|
Возраст >35 лет |
|
|
ИМТ >30 |
|
|
Курение |
|
|
Выраженное варикозное расширение вен ** |
|
|
Преэклампсия |
|
|
Многоплодная беременность |
|
|
Плановое кесарево сечение, другие оперативные пособия |
|
|
Затяжные роды (>24 часов) |
|
|
Тяжелое послеродовое кровотечение (кровопотеря более 1 л или необходимость трансфузионной терапии) |
|
|
Преждевременные роды до 37 нед в настоящую беременность |
|
|
Антенатальная, интранатальная гибель плода в настоящую беременность |
|
|
Количество родов ≥ 3 |
|
|
Системная инфекция, иммобильность, обезвоживание |
|
|
ЭКО |
|
|
Длительные поездки (свыше 4-6 часов) |
* Эпизод ТФПВ может рассматриваться как возможное проявление тромбофилического состояния, поэтому при случившемся ТФПВ целесообразно объединение всех форм наследственной тромбофилии, антифосфолипидного синдрома и гипергомоцистеинемии тяжелой степени в факторы высокого риска рецидива ВТЭО в текущую беременность.
**Варикозное расширение вен голени с симптомами, или с перенесенным тромбофлебитом, или с венозным отеком, или с трофическими изменениями мягких тканей
Ключ: фактор риска относится к категории низкого, среднего или высокого риска в соответствии с таблицей.
Пояснения: данная градация факторов риска ВТЭО во время беременности и в послеродовом периоде разработана с учетом клинических рекомендаций РОАГ 2014 г. и RCOG 2015 г. [89,113,114]. Наличие факторов риска ВТЭО в зависимости от их количества и значимости учитывается в определении тактики лечения ТФПВ при беременности или в послеродовом периоде (см. раздел 3.1.6. «Тромбофлебит поверхностных вен во время беременности и в послеродовом периоде», Приложение А3.4. «Тактика лечения ТФПВ во время беременности», Приложение А3.5. «Тактика лечения ТФПВ в послеродовом периоде».
Содержание
- <span style="color: #ff0000;">Рекомендации утратили силу</span>
- Флебит и тромбофлебит поверхностных сосудов
- Текст в pdf
- Список сокращений
- Термины и определения
- 1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
- 1.0. Определение заболевания или состояния (группы заболеваний или состояний)
- 1.1. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
- 1.2. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
- 1.3. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- 1.4. Классификация заболевания или состояния (группы заболеваний или состояний)
- 1.5. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
- 2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
- 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- 3.0. Общие положения и тактика лечения ТФПВ
- 3.1. Особые ситуации, влияющие на тактику обследования и лечения
- 3.1.1. Симультанный ТГВ или переход тромба на глубокие вены
- 3.1.2. Тромбофлебит неварикозных поверхностных вен
- 3.1.3. Рецидивирующий тромбофлебит
- 3.1.4. Гнойный тромбофлебит
- 3.1.5. Тромбофлебит поверхностных вен верхних конечностей
- 3.1.6. Тромбофлебит поверхностных вен во время беременности и в послеродовом периоде
- 3.1.6.1. Общие положения
- 3.1.6.2. Показания к госпитализации
- 3.1.6.3. Тактика при остром и стихающем тромбофлебите во время беременности
- 3.1.6.4. Тактика при выявлении стихшего ТФПВ, развившегося во время беременности
- 3.1.6.5. Тактика при остром и стихающем тромбофлебите в послеродовом периоде
- 3.1.6.6. Тактика при выявлении в послеродовом периоде стихшего тромбофлебита, развившегося во время беременности
- 3.1.6.7. Особенности антикоагулянтной терапии на фоне беременности и послеродового периода
- 3.1.6.8. Родоразрешение у женщин, получающих НМГ в связи с ТФПВ
- 3.1.6.9. Другая медикаментозная терапия ТФПВ на фоне беременности и в послеродовом периоде, в т.ч. в период грудного вскармливания
- 3.1.7. Тромбофлебит поверхностных вен у онкологических пациентов
- 3.1.8. Мигрирующий тромбофлебит, тромбофлебит Мондора
- 3.2. Эластичная компрессия и локальная гипотермия
- 3.3. Медикаментозная терапия
- 3.3.1. Антибиотики (Антибактериальные препараты системного действия, АТХ J01)
- 3.3.2. Нестероидные противовоспалительные и противоревматические препараты (АТХ M01A)
- 3.3.3. Антикоагулянты (препараты из группы АТХ B01A Антитромботические средства)
- 3.3.3.1. Гепарин натрия** (антикоагулянты прямого действия, АТХ B01AB01)
- 3.3.3.2. Гепарины низкомолекулярные (АТХ группа: B01AB Группа гепарина)
- 3.3.3.3. Фондапаринукс натрия (прочие антикоагулянты, АТХ B01AX)
- 3.3.3.4. Прямые ингибиторы фактора Xa (АТХ B01AF)
- 3.3.3.5. Антагонисты витамина К (АТХ B01AA)
- 3.3.3.6. Салициловая кислота и ее производные (АТХ N02BA)
- 3.3.3.7. Сулодексид (группа: B01AB Группа гепарина)
- 3.3.4. Ингибиторы ГМГ-КоА-редуктазы (АТХ C10AA)
- 3.3.5. Биофлавоноиды (АТХ C05CA)
- 3.3.6. Препараты для местного применения
- 3.4. Хирургическое лечение
- 4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
- 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- 6. Организация оказания медицинской помощи
- 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Критерии оценки качества медицинской помощи
- Список литературы
- Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Приложение А2. Методология разработки клинических рекомендаций
- Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
- Приложение А 3.1. Факторы риска геморрагических осложнений во время беременности, родов или в послеродовом периоде
- Приложение А 3.2. Профилактические дозы НМГ (АХТ: B01AB Группа гепарина) в зависимости от массы тела до беременности
- Приложение А 3.3. Лечебные дозы НМГ (АХТ: B01AB Группа гепарина) в зависимости от массы тела до беременности
- Приложение А 3.4. Тактика лечения ТФПВ во время беременности
- Приложение А 3.5. Тактика лечения ТФПВ в послеродовом периоде
- Приложение А 3.6. Промежуточные дозы низкомолекулярных гепаринов (НМГ, АТХ: B01AB Группа гепарина)
- Приложение Б. Алгоритмы действий врача
- Приложение В. Информация для пациентов
- Приложения Г1, Г2. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.